Sarcomere-structuur en delen, functies en histologie
een sarcomeer het is de fundamentele functionele eenheid van gestreept spierweefsel, dat wil zeggen skelet- en hartspier. Skeletspier is het type spier dat wordt gebruikt bij vrijwillige beweging en de hartspier is de spier die deel uitmaakt van het hart.
Om te zeggen dat de sarcomeer de functionele eenheid is, betekent dit dat alle componenten die nodig zijn voor samentrekking in elk sarcomeer aanwezig zijn. In feite bestaat de gestreepte spier uit miljoenen kleine sarcomeren die, individueel, met elke spiercontractie inkorten.
Hier ligt het hoofddoel van de sarcomeer. De sarcomeren kunnen grote bewegingen initiëren door eendrachtig samen te trekken. Dankzij de unieke structuur kunnen deze kleine eenheden de contracties van de spieren coördineren.
In feite zijn de samentrekkende eigenschappen van spieren een bepalend kenmerk van dieren, omdat de beweging van dieren opmerkelijk soepel en complex is. Locomotion vereist een verandering in de lengte van de spier terwijl deze buigt, wat een moleculaire structuur vereist die spierverkorting mogelijk maakt.
index
- 1 Structuur en onderdelen
- 1.1 Myofibrils
- 1.2 Myosin en actine
- 1.3 Myofilamenten
- 2 functies
- 2.1 Deelname van myosin
- 2.2. Unie van myosin en actiba
- 3 Histologie
- 3.1 Band A
- 3.2 Zone H
- 3.3 Band I
- 3.4 Z-schijven
- 3.5 Lijn M
- 4 Referenties
Structuur en onderdelen
Als het skeletspierweefsel nauwkeurig wordt onderzocht, wordt een gestreepte verschijning met de naam striation waargenomen. Deze "strepen" vertegenwoordigen een patroon van afwisselende banden, licht en donker, overeenkomend met verschillende eiwitfilamenten. Dat wil zeggen, deze strepen worden gevormd door verstrengelde eiwitvezels die elk sarcomeer vormen.
myofibrils
Spiervezels zijn samengesteld uit honderden tot duizenden contractiele organellen, myofibrillen genaamd; Deze myofibrillen zijn parallel gerangschikt om spierweefsel te vormen. De myofibrillen zelf zijn echter in wezen polymeren, dat wil zeggen repetitieve eenheden van sarcomeren.
Myofibrillen zijn vezelige en lange structuren en bestaan uit twee soorten eiwitfilamenten die op elkaar worden gestapeld.
Myosin en actine
Myosine is een dikke vezel met een bolvormig hoofd en actine is een dunnere vezel die samenwerkt met myosine tijdens het proces van spiercontractie.
Een gegeven myofibril bevat ongeveer 10.000 sarcomeren, die elk ongeveer 3 micrometer lang zijn. Hoewel elk sarcomeer klein is, overspannen verschillende sarcomeren de lengte van de spiervezels.
myofilamenten
Elke sarcomeer bestaat uit dikke, dunne bundels van de hierboven genoemde eiwitten, die samen myofilamenten worden genoemd.
Door een deel van de myofilamenten uit te breiden, kun je de moleculen identificeren die ze vormen. De dikke filamenten zijn gemaakt van myosine, terwijl de fijne filamenten gemaakt zijn van actine.
Actine en myosine zijn de contractiele eiwitten die spierverkorting veroorzaken wanneer ze met elkaar interageren. Bovendien bevatten dunne filamenten andere eiwitten met regulerende functie, troponine en tropomyosine, die de interactie tussen contractiele eiwitten reguleren.
functies
De belangrijkste functie van de sarcomeer is om een spiercel te laten samentrekken. Hiervoor moet de sarcomeer worden ingekort als reactie op een nerveuze impuls.
De dikke en dunne filamenten verkorten niet, maar glijden om elkaar heen, waardoor de sarcomeer korter wordt terwijl de filamenten dezelfde lengte behouden. Dit proces staat bekend als het model van de glijdende filamenten van spiercontractie.
Het glijden van de gloeidraad genereert spierspanning, wat ongetwijfeld de belangrijkste bijdrage van de sarcomeer is. Deze actie geeft de spieren hun fysieke kracht.
Een snelle analogie hiervan is de manier waarop een lange ladder kan worden uitgebreid of gevouwen afhankelijk van onze behoeften, zonder de metalen onderdelen fysiek te verkorten..
Myosin betrokkenheid
Gelukkig biedt recent onderzoek een goed idee van hoe deze ontsporing werkt. De theorie van de glijdende gloeidraad is aangepast om te omvatten hoe myosine actine kan trekken om de lengte van de sarcomeer te verkorten.
In deze theorie bevindt de bolvormige kop van myosine zich dichtbij actine in een gebied dat het S1-gebied wordt genoemd. Dit gebied is rijk aan segmenten met scharnieren die kunnen worden gebogen en die de samentrekking vergemakkelijken.
De flexie van S1 kan de sleutel zijn om te begrijpen hoe myosine in staat is om langs de actinefilamenten te 'lopen'. Dit wordt bereikt door bindingscycli van het S1-myosinefragment, de samentrekking en de uiteindelijke afgifte ervan.
Unie van myosin en actiba
Wanneer myosine en actine samenkomen, vormen ze verlengingen die 'gekruiste bruggen' worden genoemd. Deze gekruiste bruggen kunnen worden gevormd en breken met de aanwezigheid (of afwezigheid) van ATP, het energiemolecuul dat contractie mogelijk maakt.
Wanneer ATP aan het actine-filament bindt, verplaatst het het naar een positie die zijn myosinebindingsplaats blootlegt. Hierdoor kan de bolvormige kop van de myosine zich hechten aan deze site om de kruisbrug te vormen.
Deze unie zorgt ervoor dat de fosfaatgroep van ATP dissocieert en dus start de myosine zijn functie. Daarna komt de myosine in een toestand van lagere energie waar de sarcomeer kan worden ingekort.
Om de kruisbrug te verbreken en opnieuw de binding van myosine aan actine in de volgende cyclus mogelijk te maken, is het noodzakelijk om een ander molecuul ATP aan myosine te binden. Dat wil zeggen, het ATP-molecuul is noodzakelijk voor zowel samentrekking als ontspanning.
histologie
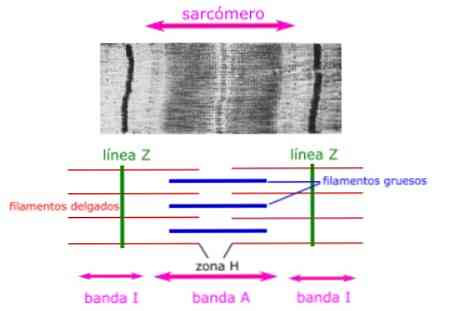
De histologische delen van de spier tonen de anatomische kenmerken van de sarcomeren. De dikke filamenten, samengesteld uit myosine, zijn zichtbaar en worden weergegeven als de A-band van een sarcomeer.
Dunne filamenten, samengesteld uit actine, binden aan een eiwit op de Z-schijf (of Z-lijn) genaamd alfa-actinine en zijn aanwezig over de gehele lengte van band I en een deel van band A.
Het gebied waar de dikke en dunne filamenten elkaar overlappen heeft een dicht uiterlijk, omdat er weinig ruimte tussen de filamenten is. Dit gebied waar dunne en dikke filamenten elkaar overlappen is erg belangrijk voor spiercontractie, omdat dit de plaats is waar de beweging van het filament begint.
De dunne filamenten strekken zich niet volledig uit in banden A, waarbij een centraal gebied van band A achterblijft dat alleen dikke filamenten bevat. Dit centrale gebied van band A lijkt iets lichter dan de rest van band A en wordt zone H genoemd.
Het midden van zone H heeft een verticale lijn genaamd de M-lijn, waar accessoire-eiwitten de dikke filamenten bij elkaar houden.
De belangrijkste componenten van de histologie van een sarcomeer zijn hieronder samengevat:
Band A
Dikke gloeidraadzone, samengesteld uit myosine-eiwitten.
Zone H
Centrale zone van band A, zonder actine-eiwitten gesuperponeerd als de spier ontspannen is.
Band I
Zone van dunne filamenten, samengesteld uit actine-eiwitten (zonder myosine).
Z-schijven
Zijn de grenzen tussen aangrenzende sarcomeren, gevormd door actine bindende eiwitten loodrecht op de sarcomeer.
Lijn M
Centrale zone gevormd door aanvullende eiwitten. Ze bevinden zich in het midden van de dikke draad van myosine, loodrecht op de sarcomeer.
Zoals hierboven vermeld, treedt krimp op wanneer de dikke filamenten snel achter elkaar over de fijne filamenten glijden om de myofibrillen te verkorten. Een cruciaal onderscheid om te onthouden is echter dat de myofilamenten zelf niet samentrekken; het is de glijdende actie die hen hun kracht geeft om te verkorten of te verlengen.
referenties
- Clarke, M. (2004). De glijdende gloeidraad op 50. natuur, 429(6988), 145.
- Hale, T. (2004) Oefenfysiologie: een thematische aanpak (1e ed.). Wiley
- Rhoades, R. & Bell, D. (2013). Medical Physiology: Principles for Clinical Medicine (4de ed.). Lippincott Williams & Wilkins.
- Spudich, J.A. (2001). Het myosin swingende cross-bridge model. Nature evalueert moleculaire celbiologie, 2(5), 387-392.
- Thibodeau, P. (2013). Anatomie en fysiologie (8th). Mosby, Inc.
- Tortora, G. & Derrickson, B. (2012). Principes van anatomie en fysiologie (13de ed.). John Wiley & Sons Inc.


