Helicobacter pylori-kenmerken, morfologie, habitat, pathologie
Helicobacter pylori is een Gram-negatieve spiraalvormige bacterie, betrokken bij de ontwikkeling van gastritis, maagzweren en geassocieerd met maagkanker. Het werd in 1983 ontdekt door de Australische pathologen Robin Warren en Barry Marshall bij het onderzoeken van de maagslijmvliezen van menselijke magen.
Zelfs Marshall experimenteerde met zichzelf, het innemen van materiaal besmet met de bacteriën, waar hij vond dat het gastritis produceerde, en in staat was om de aanwezigheid van de bacteriën in zijn eigen maag biopsie te controleren. Hij ontdekte ook dat hij reageerde op de behandeling met antibiotica.
Deze ontmantelde oude theorieën die beweerden dat gastritis werd veroorzaakt door het eten van gekruid voedsel of stress. Om deze reden kregen Warren en Marshal in 2005 de Nobelprijs voor de geneeskunde.
index
- 1 Algemene kenmerken
- 2 Habitat
- 3 Virulentiefactoren
- 3.1 Flagella
- 3.2 Adhesines
- 3.3 Lipopolysacchariden (LPS)
- 3.4 Ureum
- 3.5 vacuumiserend cytotoxine (VacA)
- 3.6 Cytotoxine (CagA)
- 3.7 Superoxide dismutase en catalase
- 3.8 Door stikstofoxide geïnduceerde synthese (iNOS):
- 3.9 Fosfolipasen, lipasen en mucinasen
- 4 Taxonomie
- 5 Morfologie
- 6 Diagnose
- 6.1 - Invasieve methoden
- 6.2 Niet-invasieve methoden
- 7 Levenscyclus
- 8 Pathogenese
- 8.1 Inflammatory infiltrate
- 9 Pathologie
- 10 klinische manifestaties
- 11 Besmetting
- 12 Behandeling
- 13 Referenties
Algemene kenmerken
Vanwege zijn grote gelijkenis met het Campylobacter-genus, werd het aanvankelijk genoemd Campylobacter pyloridis en later Campylobacter pylori, maar toen werd het geherclassificeerd naar een nieuw genre.
De infectie door Helicobacter pylori Het heeft een brede verspreiding in veel voornamelijk onderontwikkelde landen en is een van de meest voorkomende infecties bij de mens, die meestal voorkomt sinds de kindertijd.
Men vermoedt dat het voor de eerste keer het micro-organisme heeft verkregen, dit kan jarenlang of levenslang blijven, in sommige gevallen asymptomatisch.
Aan de andere kant lijkt de maag niet de enige plaats te zijn waar het micro-organisme kan worden gehuisvest, men gelooft dat H. pylori kan worden geconsolideerd in de mond voordat de maag wordt gekoloniseerd.
Evenzo is het mogelijk dat H. pylori aanwezig in de mondholte kan de maag opnieuw infecteren, na behandeling. Dit wordt versterkt door te constateren dat sommige asymptomatische kinderen zijn geïsoleerd van de tandplak.
Echter, hoewel de infectie Helicobacter pylori Asymptomatische beloop bij sommige mensen, dit is niet ongevaarlijk, het is gerelateerd aan 95% van duodenale ulcera, 70% aan maagzweren en 100% aan chronische gastritis van antrale locatie.
ook, Helicobacter pylori is door het International Agency for Research on Cancer geclassificeerd als een klasse I carcinogeen vanwege het verband tussen infectie en maagkanker.
leefgebied
Helicobacter pylori is gevonden in de volgende gasten: man, aap en katten.
Deze bacterie heeft een micro-aerofiele atmosfeer (10% CO)2, 5% van O2 en 85% van N2) worden gekweekt, ijzer is een essentieel element voor zijn groei en metabolisme.
De optimale groeitemperatuur ligt tussen 35 en 37 ºC, hoewel sommige stammen zich bij 42 ºC kunnen ontwikkelen. Op dezelfde manier bevordert een bepaalde vochtigheid de groei.
Helicobacter pylori Het groeit langzaam in het laboratorium, kan 3 tot 5 dagen nodig hebben en zelfs tot 7 dagen om de kolonie in het midden te laten zien.
Voor de kweek kunnen niet-selectieve media worden gebruikt aangevuld met bloed.
Aan de andere kant, Helicobacter pylori Het wordt gekenmerkt door mobiel te zijn en door de spirale vorm kan het bewegingen in de schroeflijn hebben alsof het is vastgeschroefd. Dit helpt je te mobiliseren door middel van maag-slijm.
Het is ook katalase en oxidase positief en een grote producent van urease, de laatste speelt een vitale rol voor het micro-organisme. Met Urease kan het overleven in omgevingen met een zure pH door ammoniak te produceren, wat helpt de pH te alkaliseren.
Het micro-organisme heeft een pH van 6 tot 7 nodig om te prolifereren. Hiervoor wordt het, naast het gebruik van urease, geïnstalleerd om onder het maagslijmvlies te leven, waar maagmucel het beschermt tegen de extreme zuurgraad van het maaglumen (pH 1,0 - 2,0).
Aan de andere kant modificeren de proteasen die de bacteriën uitscheiden het maagslijm, waardoor de mogelijkheid dat het zuur door het slijm diffundeert wordt verkleind..
Virulentiefactoren
plagen
De beweging van de bacteriën vertegenwoordigt een virulentiefactor omdat het helpt bij het koloniseren van het maagslijmvlies.
adhesine
De bacterie presenteert pilimis en fimbrial hemagglutinine, die inwerken op de hechting van het micro-organisme aan de maag- en duodenumcellen.
Hechting is een strategie van de bacteriën om weerstand te bieden aan de peristaltiek van de mucosale laag waar ze verblijven, om later te migreren naar de epitheliale cellen.
Aan de andere kant vertragen specifieke hemagglutinines van siaalzuur op het slijmoppervlak de hechting en opname van H. pylori.
Lipopolysacchariden (LPS)
Het is endotoxisch evenals het LPS van andere Gram-negatieve bacteriën. Gezuiverd antigeen kan apoptose induceren.
urease
De bacteriën maken gebruik van de productie van urease om ureum af te breken in ammoniak en koolstofdioxide.
Deze actie maakt het mogelijk om een alkalische pH rond de pH te handhaven en zo te voorkomen dat het wordt vernietigd door het zoutzuur in de maag, wat de overleving ervan garandeert.
Deze eigenschap wordt gecodeerd door het Ura A-gen.
Vacuolizing cytotoxin (VacA)
Het is een eiwit dat vacuolen in de epitheliale cellen van de maag veroorzaakt, wat de reden is waarom het weefsel ulcereert. Het wordt gecodeerd door het VacA-gen.
Cytotoxine (CagA)
De stammen met het CagA-gen zijn virulenter. Deze zijn geassocieerd met ernstige gastritis, atrofische gastritis, duodenitis en / of maagkanker.
Dit CagA-cytotoxine verhoogt de proliferatie van maagcellen zonder apoptose, wat leidt tot een wijziging in het normale vernieuwingspatroon van het maagepitheel..
Superoxide dismutase en catalase
Het is essentieel voor bescherming tegen O2-afhankelijke sterfte door neutrofielen.
Het werkt door het afbreken van waterstofperoxide, een metaboliet die giftig is voor bacteriën.
Induceerbare stikstofoxidesynthase (iNOS):
De bacterie induceert iNOS en macrofagen in vitro.
Deze bevinding suggereert dat de hoge productie van stikstofoxide door de inductie van dit synthase, in samenhang met immuunactivatie, deelneemt aan weefselschade..
Fosfolipasen, lipasen en mucinasen
Ze laten de invasie van het micro-organisme onder het maagslijmvlies toe, om vervolgens het slijm te modificeren zodat het functioneert als een waterbestendige laag die het beschermt tegen het zuur van het maaglumen.
Ook op deze locatie is de immuunrespons volledig ineffectief.
taxonomie
domein: bacterie
phylum: proteobacteria
klasse: epsilonproteobacteria
volgorde: campylobacterales
familie: Helicobacteraceae
genre: Helicobacter
soorten: pylori
morfologie
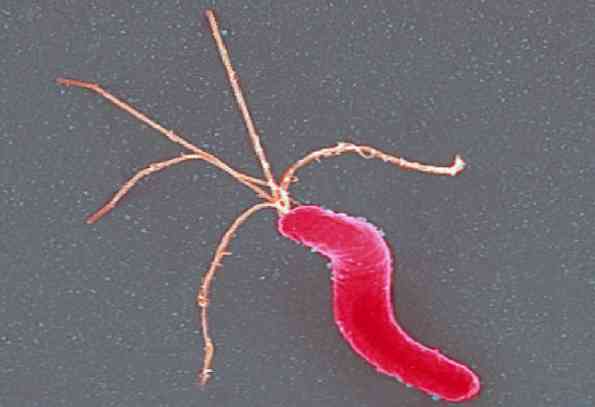
Helicobacter pylori Het is een dunne Gram-negatieve spiraalvormige bacillus, klein, gebogen en enigszins stomppig. Het meet ongeveer 3 μm lang en 0,5 μm breed. Kleur goed met hematoxyline-eosine, gemodificeerde Giensa-kleuring of Warthin-Starry-techniek.
Het is mobiel dankzij de aanwezigheid van meerdere polaire flagella's (in tuft), tussen 4 en 6 in totaal die kenmerkend zijn omhuld.
De omhulling die de flagella bedekt bevat eiwitten en lipopolysaccharide equivalent aan de componenten van het buitenmembraan. De functie is echter onbekend.
Het vormt geen sporen en is niet afgetopt. De celwand lijkt op die van andere Gram-negatieve bacteriën.
De kolonies van Helicobacter pylori Ze zijn meestal klein grijs en doorschijnend. Wanneer de koloniën verouderen (langdurige culturen) worden de bacillaire vormen coccoïde.
diagnose
Voor de diagnose van Helicobacter pylori er zijn veel methoden en ze zijn geclassificeerd als invasief en niet-invasief.
-Invasieve methoden
Maagslijmvlies biopsie
Het wordt genomen via een endoscopie, de meest gevoelige methode voor de diagnose van Helicobacter pylori.
Micro-organismen kunnen worden waargenomen in weefselcoupes en het slijmvlies zal pathognomonische kenmerken van zijn aanwezigheid vertonen.
Het nadeel is dat de verdeling van H. pylori door de maag is niet uniform.
Snelle urease-test
Het is een methode voor indirecte detectie van de bacterie.
Delen van de monsters kunnen worden ondergedompeld in ureumvloeistof met een pH-indicator (fenolrood) en in minder dan een uur kunnen de resultaten worden waargenomen.
Het medium ureumbouillon verandert van geel naar fuchsia vanwege de pH-verandering veroorzaakt door de productie van ammoniak uit ureum, door de werking van urease.
De gevoeligheid van deze test hangt af van de bacteriële belasting in de maag.
Teelt van maagslijmvliesmonsters
Een deel van het door endoscopie genomen monster kan bestemd zijn om te worden gekweekt. Een negatieve cultuur is de meest gevoelige indicator van een kuur na de behandeling.
Het biopsiemonster voor de maag of de duodenus moet recent zijn en het transport mag niet langer dan 3 uur worden uitgesteld. Ze kunnen tot 5 uur bij 4 ° C worden bewaard en het weefsel moet vochtig worden gehouden (container met 2 ml steriele fysiologische zoutoplossing).
Vóór het zaaien van het monster moet een maceraat worden gemaakt om een grotere gevoeligheid te verkrijgen. Het monster kan worden uitgeplaat op Brucella-agar, hersenhartinfusie of sojaboon-trypticase aangevuld met 5% schapen- of paardenbloed.
Polymerase kettingreactie (PCR).
Weefseldelen kunnen worden onderworpen aan moleculaire biologietechnieken voor het detecteren van DNA van micro-organismen.
Het voordeel van PCR is dat het kan worden gebruikt bij de analyse van monsters zoals speeksel, waarmee de diagnose kan worden gesteld H. pylori niet-invasief, hoewel het feit dat de bacterie in speeksel is niet noodzakelijkerwijs een teken van maag-infectie is.
-Niet-invasieve methoden
serologie
Deze methode heeft een gevoeligheid van 63-97%. Het bestaat uit het meten van IgA-, IgM- en IGG-antilichamen door middel van de ELISA-techniek. Het is een goede diagnostische optie, maar het heeft beperkt gebruik voor behandelingscontrole.
Dit komt omdat de antilichamen tot 6 maanden nadat het micro-organisme is verwijderd opgeheven kunnen blijven. Het heeft het voordeel dat het een snelle, eenvoudige en goedkopere methode is dan diegene die een biopsie-endoscopie vereisen.
Opgemerkt moet worden dat de antilichamen gegenereerd tegen H. pylori, Ze dienen voor de diagnose, maar voorkomen kolonisatie niet. Daarom mensen die verwerven H. pylori hebben de neiging om aan chronische ziekten te lijden.
Ademtest
Voor deze test moet de patiënt ureum gemerkt met koolstof inslikken (13C o 14C). Deze verbinding, wanneer deze in contact wordt gebracht met het urease dat door de bacteriën wordt geproduceerd, wordt omgezet in gemerkt kooldioxide (CO2 C14) en Ammonium (NH2).
De koolstofdioxide komt in de bloedbaan en van daar naar de longen waar het wordt uitgeademd door de adem. Het ademmonster van de patiënt wordt verzameld in een ballon. Een positieve test is een bevestiging van infectie door deze bacterie.
Gemodificeerde ademtest
Het is gelijk aan het vorige, maar in dit geval wordt een colloïde van 99mTc toegevoegd die niet wordt opgenomen in het spijsverteringsstelsel.
Dit colloïde maakt het mogelijk om de productie van ureum precies op de plaats van het spijsverteringsstelsel waar het wordt gegenereerd door een gammacamera, te visualiseren.
Levenscyclus
Helicobacter pylori In het organisme gedraagt het zich op twee manieren:
98% van de bevolking van H. pylori ze verblijven vrij in het slijm van de maag. Dit dient als een reservoir voor hechtende bacteriën en dient voor transmissie.
Terwijl 2% gehecht is aan epitheelcellen, die de infectie handhaven.
Daarom zijn er twee populaties, aanhangend en niet-volgend, met verschillende overlevingskenmerken.
pathogenie
Zodra de bacterie het lichaam binnenkomt, kan het voornamelijk het maag-antrum koloniseren, met behulp van de virulentiefactoren die het heeft..
De bacterie kan lang in het maagslijmvlies blijven, soms levenslang zonder ongemak te veroorzaken. Binnendringt en koloniseert de diepe lagen van het slijm van de maag en de twaalfvingerige darm door proteasen en fosfolipasen.
Het hecht zich vervolgens aan de oppervlakkige epitheelcellen van het slijmvlies van de maag en de twaalfvingerige darm, zonder de muur binnen te dringen. Dit is een strategische locatie die de bacteriën gebruiken om zichzelf te beschermen tegen de extreem zure pH van het maaglampje.
Gelijktijdig op deze site ontvouwt de bacterie het ureum om zijn omgeving verder te alkaliseren en levensvatbaar te blijven.
Meestal is er een continue ontstekingsreactie in het maagslijmvlies, die op zijn beurt de regulatiemechanismen van de maagzuurafscheiding verandert. Dit is hoe bepaalde ulcerogene mechanismen worden geactiveerd, zoals:
Remming van de functie van pariëtale cellen door remming van somatostatine, waarbij ontoereikende gastrineproductie de voorkeur geniet.
De geproduceerde ammoniak plus het VacA-cytotoxine mishandelen de epitheliale cellen en veroorzaken aldus laesies in de maag- of duodenummucosa.
Daarom worden degeneratieve veranderingen van het epitheliale oppervlak waargenomen, waaronder mucinedepletie, cytoplasmatische vacuolisatie en desorganisatie van de slijmklieren..
Inflammatory infiltrate
De hiervoor genoemde verwondingen resulteren in het slijmvlies en zijn lamina propria worden binnengevallen door een dicht infiltraat van ontstekingscellen. Aanvankelijk kan het infiltraat minimaal zijn met alleen mononucleaire cellen.
Maar dan kan de ontsteking zich verspreiden met de aanwezigheid van neutrofielen en lymfocyten, die schade aan de slijmvliezen en pariëtale cellen veroorzaken en er kan zelfs een vorming van microabces zijn.
Het cytotoxine CagA gaat de maag epitheliale cel binnen, waar meerdere enzymatische reacties die de reorganisatie van het actine cytoskelet veroorzaken worden getriggerd.
De specifieke mechanismen van carcinogenese zijn onbekend. Er wordt echter aangenomen dat ontsteking en agressie gedurende een lange tijdsperiode resulteren in metaplasie en langdurige kanker.
pathologie
Over het algemeen komt chronische oppervlakkige gastritis voort in enkele weken of maanden nadat de bacteriën zijn geïnstalleerd. Deze gastritis kan overgaan tot een maagzweer en vervolgens een lymfoom of gastrisch adenocarcinoom veroorzaken.
Ook infectie door Helicobacter pylori is een aandoening die predisponeert om te lijden aan MALT lymfoom (lymfoom van het lymfoïde weefsel geassocieerd met de mucosae).
Aan de andere kant vermelden de nieuwste studies dat Helicobacter pylori veroorzaakt extra maagziekten. Hiervan kunnen worden genoemd: ijzertekort bloedarmoede en idiopathische trombocytopenie purpura.
Ook huidaandoeningen zoals rosacea (meest voorkomende huidziekte geassocieerd met H. pylori), chronische prurigo, chronische idiopathische urticaria, psoriasis en andere. Bij zwangere vrouwen kan hyperemesis gravidarum produceren.
Andere minder frequente sites waarvan wordt geloofd dat H. pylori kan enige betrokkenheid hebben die pathologie veroorzaakt op het niveau van:
Middenoor, neuspoliepen, lever (hepatocellulair carcinoom), galblaas, longen (bronchiëctasie en chronische obstructieve longziekte COPD).
Het is ook in verband gebracht met oculaire aandoeningen (openhoek-glaucoom), hart- en vaatziekten, auto-immuunziekten, onder andere..
Klinische manifestaties
Deze pathologie kan asymptomatisch zijn bij maximaal 50% van de volwassenen. Anders kan bij de primaire infectie misselijkheid en pijn in de bovenbuik ontstaan die tot twee weken kan aanhouden.
Later verdwijnen de symptomen, om later weer te verschijnen nadat de gastritis en / of maagzweer is geïnstalleerd.
In dit geval zijn de meest voorkomende symptomen misselijkheid, anorexia, braken, epigastrische pijn en nog minder specifieke symptomen zoals boeren.
Maagzweren kunnen ernstige bloedingen veroorzaken die gecompliceerd kunnen worden door peritonitis als gevolg van lekkage van maaginhoud in de peritoneale holte.
besmetting
Mensen met Helicobacter pylori Ze kunnen de bacteriën in de ontlasting afscheiden. Op deze manier kan drinkwater worden verontreinigd. Daarom is de belangrijkste route van besmetting van het individu fecaal-oraal.
Er wordt aangenomen dat het kan in water of in sommige groenten die meestal rauw worden gegeten, zoals sla en kool..
Deze voedingsmiddelen kunnen besmet raken door te worden geïrrigeerd met verontreinigd water. Het micro-organisme is echter nog nooit geïsoleerd van water.
Een andere manier van besmetting is de oraal-orale route, maar deze werd in Afrika gedocumenteerd door de gewoonte van sommige moeders om het voedsel van hun kinderen voor te kauwen..
Ten slotte is besmetting via de iatrogene route mogelijk. Deze route bestaat uit contaminatie door het gebruik van verontreinigd of slecht gesteriliseerd materiaal bij invasieve procedures waarbij contact met het maagslijmvlies is betrokken..
behandeling
Helicobacter pylori in vitro Het is gevoelig voor een verscheidenheid aan antibiotica. Onder hen: penicilline, enkele cefalosporinen, macroliden, tetracyclines, nitroimidazolen, nitrofuranen, chinolonen en bismutzouten.
Maar ze zijn intrinsiek resistent tegen receptorblokkers (cimetidine en ranitidine), polymyxine en trimethoprim.
Onder de meest succesvolle behandelingen hebben we:
- Combinatie van medicijnen, waaronder 2 antibiotica en 1 protonpompremmer.
- De meest gebruikte combinatie van antibiotica is claritromycine + metronidazol of claritromycine + amoxicilline of claritromycine + furazolidon of metronidazol + tetracycline..
- De protonpompinhibitor kan Omeprazol of Esomeprazol zijn.
- Sommige therapieën kunnen ook de consumptie van bismutzouten omvatten.
De therapie moet gedurende ten minste 14 dagen worden voltooid, zoals aanbevolen door de FDA. Bij sommige patiënten is deze therapie echter moeilijk te verdragen. Voor hen is het aanbevolen om de behandeling te combineren met de consumptie van voedingsmiddelen die probiotica bevatten.
Deze therapieën zijn effectief, maar de laatste jaren is er weerstand geweest Helicobacter pylori metronidazol en claritromycine.
Het micro-organisme kan worden uitgeroeid, maar herinfectie is mogelijk. Bij de tweede behandeling vanwege herinfectie wordt het gebruik van levofloxacine aanbevolen.
referenties
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Microbiologische diagnose. (5de ed.). Argentinië, redactie Panamericana S.A..
- Forbes B, Sahm D, Weissfeld A. Bailey & Scott Microbiological Diagnosis. 12 ed. Argentinië. Editorial Panamericana S.A; 2009.
- Ryan KJ, Ray C. Sherris. microbiologie Medical, 6e editie McGraw-Hill, New York, V.S. 2010.
- Cava F en Cobas G. Twee decennia van Helicobacter pylori. VacciMonitor, 2003; 2 (1): 1-10
- González M, González N. Handleiding of Medical Microbiology. 2e editie, Venezuela: Directoraat van media en publicaties van de Universiteit van Carabobo; 2011
- Testerman TL, Morris J. Beyond the stomach: een bijgewerkt beeld van de pathogenese van Helicobacter pylori, diagnose en behandeling. World J Gastroenterol. 2014; 20 (36): 12781-808.
- Safavi M, Sabourian R, Foroumadi A. Behandeling van Helicobacter pylori-infectie: huidige en toekomstige inzichten. World J Clin Cases. 2016; 4 (1): 5-19.


