Paden van de Pentose-fasen en gerelateerde ziekten
de pad van de pentosen fosfaat, ook bekend als forwarding monofosfaat hexosen, een fundamenteel metabolische route waarvan het eindproduct de ribose die nodig zijn voor de synthese routes van nucleotiden en nucleïnezuren, zoals DNA, RNA, ATP, NADH, FAD en co-enzym A.
Het produceert ook NADPH (nicotinamide adenine dinucleotide fosfaat), gebruikt in verschillende enzymatische reacties. Deze route is zeer dynamisch en in staat om zijn producten aan te passen afhankelijk van de momentane behoeften van de cellen.
ATP (adenosine trifosfaat) wordt beschouwd als de "energievaluta" van de cel, omdat de hydrolyse kan worden gekoppeld aan een breed scala van biochemische reacties.
Op dezelfde manier is NADPH een tweede essentiële energiemunt voor de reductieve synthese van vetzuren, cholesterol synthese, neurotransmittersynthese, fotosynthese en ontgiftingsreacties, onder anderen..
Hoewel NADPH en NADH qua structuur vergelijkbaar zijn, kunnen ze niet uitwisselbaar in biochemische reacties worden gebruikt. NADPH neemt deel aan het gebruik van vrije energie bij de oxidatie van bepaalde metabolieten voor reductieve biosynthese.
Daarentegen is NADH betrokken bij het gebruik van vrije energie uit de oxidatie van metabolieten om ATP te synthetiseren.
index
- 1 Geschiedenis en locatie
- 2 functies
- 3 fasen
- 3.1 Oxidatieve fase
- 3.2 Niet-oxidatieve fase
- 4 Gerelateerde ziekten
- 5 Referenties
Geschiedenis en locatie
De aanwijzingen voor het bestaan van deze route begonnen in het jaar 1930 dankzij de onderzoeker Otto Warburg, aan wie de ontdekking van de NADP wordt toegeschreven aan hem+.
Bepaalde waarnemingen lieten de ontdekking van de route toe, in het bijzonder de voortzetting van de ademhaling in aanwezigheid van remmers van glycolyse, zoals het fluoride-ion.
In 1950 beschreven wetenschappers Frank Dickens, Bernard Horecker, Fritz Lipmann en Efraim Racker de pentose fosfaat route.
De weefsels die betrokken zijn bij de synthese van cholesterol en vetzuren, zoals borstklieren, vetweefsel en nieren, hebben hoge concentraties pentosefosfaat-enzymen.
De lever is ook een belangrijk weefsel voor dit pad: ongeveer 30% van de oxidatie van glucose in dit weefsel vindt plaats dankzij de enzymen van de pentosefosfaatroute.
functies
De pentosefosfaatroute is verantwoordelijk voor het handhaven van de homeostase van koolstof in de cel. Evenzo synthetiseert de route de voorlopers van nucleotiden en moleculen die betrokken zijn bij de synthese van aminozuren (de structurele blokken van peptiden en eiwitten)..
Het is de belangrijkste bron van reducerend vermogen voor enzymatische reacties. Daarnaast biedt het de nodige moleculen voor anabole reacties en voor verdedigingsprocessen tegen oxidatieve stress. De laatste fase van de baan is van cruciaal belang in redox-processen onder stresssituaties.
fasen
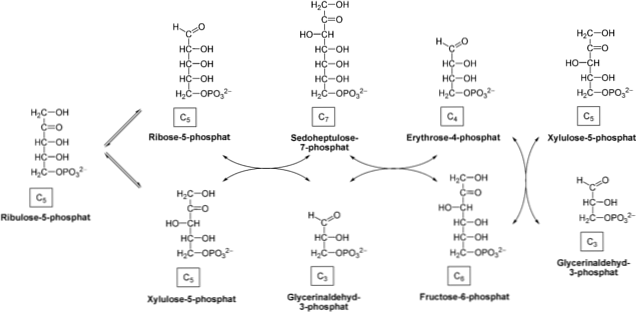
De pentosefosfaatroute bestaat uit twee fasen in het cellulaire cytosol: een oxidatieve, die NADPH genereert met de oxidatie van glucose-6-fosfaat tot ribose-5-fosfaat; en een niet-oxidatief middel, dat de onderlinge omzetting van de suikers van drie, vier, vijf, zes en zeven koolstofatomen omvat.
Deze route presenteert gedeelde reacties met de Calvin-cyclus en met de Entner-Doudoroff-route, een alternatief voor glycolyse.
Oxidatieve fase
Oxidatieve dehydrogenering fase begint met een molecuul glucose-6-fosfaat op koolstof 1. Deze reactie wordt gekatalyseerd door het enzym glucose-6-fosfaatdehydrogenase, met een hoge specificiteit voor NADP heeft+.
Het product van deze reactie is 6-fosfonoglucono-δ-lacton. Vervolgens wordt dit product gehydrolyseerd door het enzym lactonase om 6-fosfogluconaat te geven. De laatste verbinding wordt genomen door het enzym 6-fosfogluconaatdehydrogenase en wordt ribulose 5-fosfaat.
Het enzym fosfopentose-isomerase katalyseert de laatste stap van de oxidatieve fase, die de synthese van ribose-5-fosfaat door de isomerisatie van ribulose-5-fosfaat omvat..
Deze reeks reacties produceert twee moleculen NADPH en één molecuul ribose 5-fosfaat per molecuul glucose 6-fosfaat dat dit enzymatische pad binnenkomt.
In sommige cellen zijn de NADPH-vereisten groter dan die van ribose 5-fosfaat. Daarom nemen transketolase en transaldolase-enzymen ribose 5-fosfaat en zetten dit om in glyceraldehyde 3-fosfaat en fructose 6-fosfaat, waardoor plaats wordt gemaakt voor de niet-oxidatieve fase. Deze laatste twee verbindingen kunnen de glycolytische route ingaan.

Niet-oxidatieve fase
De fase begint met een epimeriseringsreactie gekatalyseerd door het enzym pentose-5-fosfaatepimerase. Ribulose-5-fosfaat wordt door dit enzym opgenomen en omgezet in xylulose-5-fosfaat.
Het product wordt door het enzym transketolase handelen met de coenzym thiaminepyrofosfaat (TPP) die de doorgang van xylulose 5-fosfaat naar ribose-5-fosfaat katalyseert. Met de overdracht van ketose naar aldose worden glyceraldehyde-3-fosfaat en sedoheptulose-7-fosfaat geproduceerd.
Brengt vervolgens transaldolase enzym C3 molecuul sedoheptulose 7-fosfaat glyceraldehyde-3-fosfaat, dat een vier-koolstofsuiker produceert (erythrose-4-fosfaat) en een zes-koolstof (fructose-6 -fosfaat). Deze producten zijn in staat om de glycolytische route te voeden.
Het enzym werkt transcetosala opnieuw overdragen C2 xylulose 5-fosfaat erythrose-4-fosfaat, wat leidt tot fructose 6-fosfaat en leiden glyceraldehyde-3-fosfaat. Net als in de vorige stap kunnen deze producten glycolyse binnengaan.
Deze tweede fase verbindt de routes die NADPH genereren met degenen die verantwoordelijk zijn voor het synthetiseren van ATP en NADH. Bovendien kunnen de producten fructose-6-fosfaat en glyceraldehyde-3-fosfaat in de gluconeogenese terechtkomen.
Gerelateerde ziekten
Verschillende pathologieën zijn gerelateerd aan de route van pentosefosfaat, tussen deze neuromusculaire ziekten en verschillende soorten kanker.
De meeste klinische studies richten zich op het kwantificeren van de activiteit van glucose-6-fosfaatdehydrogenase, omdat het het belangrijkste enzym is dat verantwoordelijk is voor het reguleren van de route.
In de bloedcellen die behoren tot individuen die gevoelig zijn voor anemie, hebben ze een lage enzymatische activiteit van glucose-6-fosfaatdehydrogenase. Daarentegen vertonen cellijnen gerelateerd aan carcinomen in het strottenhoofd een hoge enzymactiviteit.
NADPH is betrokken bij de productie van glutathione, een sleutelmolecuul in de bescherming tegen reactieve zuurstofspecies, betrokken bij oxidatieve stress.
Verschillende soorten kanker leiden tot de activering van de pentose route en worden geassocieerd met metastasen, angiogenese en reacties op chemotherapie en radiotherapiebehandelingen.
Aan de andere kant ontwikkelt chronische granulomateuze ziekte zich wanneer er een tekort is in de productie van NADPH.
referenties
- Berg, J.M., Tymoczko, J.L., Stryer, L (2002). biochemie. WH Freeman
- Konagaya, M., Konagaya, Y., Horikawa, H., & Iida, M. (1990). Pentose fosfaat route in neuromusculaire aandoeningen-evaluatie van spierglucose 6-fosfaat dehydrogenase activiteit en RNA-gehalte. Rinsho shinkeigak. Klinische neurologie, 30(10), 1078-1083.
- Kowalik, M.A., Columbano, A., & Perra, A. (2017). Nieuwe rol van de pentosefosfaatroute bij hepatocellulair carcinoom. Grenzen in de oncologie, 7, 87.
- Patra, K.C., & Hay, N. (2014). De pentosefosfaatroute en kanker. Trends in biochemische wetenschappen, 39(8), 347-354.
- Stincone, A., Prigione, A., Cramer, T., Wamelink, M., Campbell, K., Cheung, E., ... & Keller, M.A. (2015). De terugkeer van het metabolisme: biochemie en fysiologie van de pentosefosfaatroute. Biologische beoordelingen, 90(3), 927-963.
- Voet, D., & Voet, J.G. (2013). biochemie. Artmed Publisher.


