Calorimetergeschiedenis, onderdelen, typen en hun kenmerken
de calorimeter is een apparaat dat wordt gebruikt om de verandering in temperatuur te meten van een hoeveelheid substantie (meestal water) van bekende specifieke warmte. Deze verandering in temperatuur is te wijten aan de warmte die wordt geabsorbeerd of vrijgemaakt in het proces dat wordt bestudeerd; chemisch als het een reactie is, of fysiek als het bestaat uit een fase- of toestandsverandering.
In het laboratorium is de eenvoudigste calorimeter die te vinden is die van de koffiekop. Het wordt gebruikt om de warmte te meten die wordt opgenomen of afgegeven in een reactie bij constante druk, in een waterige oplossing. De reacties worden geselecteerd om de tussenkomst van reagentia of gasvormige producten te voorkomen.
 In een exotherme reactie kan de hoeveelheid warmte die vrijkomt worden berekend op basis van de stijging van de temperatuur van de calorimeter en de waterige oplossing:
In een exotherme reactie kan de hoeveelheid warmte die vrijkomt worden berekend op basis van de stijging van de temperatuur van de calorimeter en de waterige oplossing:
Hoeveelheid warmte die vrijkomt bij de reactie = hoeveelheid warmte geabsorbeerd door de calorimeter + hoeveelheid warmte geabsorbeerd door de oplossing
De hoeveelheid warmte die door de calorimeter wordt opgenomen, wordt de calorische capaciteit van de calorimeter genoemd. Dit wordt bepaald door een bekende hoeveelheid warmte toe te voeren aan de calorimeter met een gegeven massa water. Vervolgens wordt de temperatuurstijging van de calorimeter en de oplossing die deze bevat gemeten.
Met deze gegevens en het gebruik van de specifieke warmte van het water (4,18 J / g.ºC), kan de calorische capaciteit van de calorimeter worden berekend. Deze capaciteit wordt ook de calorimeterconstante genoemd.
Aan de andere kant is de warmte die wordt gewonnen door de waterige oplossing gelijk aan m · ce · Δt. In de formule m = watermassa, ce = soortelijke warmte van water en Δt = temperatuursvariatie. Als je dit allemaal weet, kun je vervolgens de hoeveelheid warmte berekenen die vrijkomt door de exotherme reactie.
index
- 1 Geschiedenis van de calorimeter
- 2 delen
- 3 Types en hun kenmerken
- 3.1 De koffiekop
- 3.2 De calorimetrische pomp
- 3.3 De adiabatische calorimeter
- 3.4 De isoperibolic calorimeter
- 3.5 De stroomcalorimeter
- 3.6 De calorimeter voor differentiële scanningcalorimetrie
- 4 toepassingen
- 4.1 In de fysiochemie
- 4.2 In biologische systemen
- 4.3 Calorimeter van zuurstofpomp en calorisch vermogen
- 5 Referenties
Geschiedenis van de calorimeter
In 1780, A. L. Lavoisier, Franse chemicus, beschouwd als een van de vaders van de chemie, gebruikte een cavia om de productie van warmte te meten door zijn ademhaling.
Hoe? Een apparaat gebruiken dat lijkt op een calorimeter. De hitte geproduceerd door de cavia werd bewezen door het smelten van de sneeuw die het apparaat omringde.
Onderzoekers A. L Lavoisier (1743-1794) en P. S. Laplace (1749-1827) ontwierpen een calorimeter die werd gebruikt om de specifieke warmte van een lichaam te meten door de methode van smeltend ijs.
De calorimeter bestond uit een vertind cilindrisch bekerglas, gevernist, vastgehouden door een statief en intern afgesloten met een trechter. Binnen werd een ander glas geplaatst, vergelijkbaar met het vorige, met een buis die door de buitenkamer ging en die was voorzien van een sleutel. In het tweede glas was een rooster.
In dit raster werd het wezen of object geplaatst waarvan de specifieke warmte gewenst was om te bepalen. IJs werd in de concentrische vaten geplaatst, net als in de mand.
De door het lichaam geproduceerde warmte werd door het ijs geabsorbeerd, waardoor de fusie plaatsvond. En het vloeibare waterproduct van het smelten van het ijs werd verzameld en de sleutel van het binnenglas geopend.
En tenslotte, als we het water wogen, was de massa van het gesmolten ijs bekend.
onderdelen
De meest gebruikte calorimeter in scheikundeonderwijslaboratoria is de zogeheten koffiekopcalorimeter. Deze calorimeter bestaat uit een beker, of in plaats daarvan, een container met anime-materiaal dat bepaalde isolerende eigenschappen heeft. In deze container wordt de waterige oplossing geplaatst met het lichaam dat warmte zal produceren of absorberen.
In het bovenste deel van de container is een afdekking van isolatiemateriaal met twee gaten geplaatst. In één wordt een thermometer geïntroduceerd om de temperatuurveranderingen te meten, en in de andere een roerder, bij voorkeur van glasmateriaal, die de functie van het verplaatsen van de inhoud van de waterige oplossing vervult..
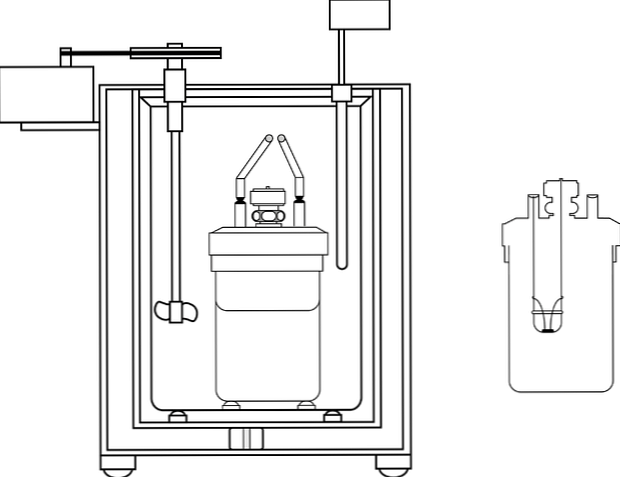
De afbeelding toont de onderdelen van een calorimetrische pomp; er kan echter worden opgemerkt dat deze de thermometer en de roerder heeft, gemeenschappelijke elementen in verschillende calorimeters.
Types en hun kenmerken
De koffiekop
Het is er een die wordt gebruikt bij de bepaling van de warmte die vrijkomt bij een exotherme reactie, en de warmte die wordt geabsorbeerd in een endotherme reactie.
Bovendien kan het worden gebruikt bij het bepalen van de specifieke warmte van een lichaam; dat wil zeggen, de hoeveelheid warmte die een gram van de stof moet opnemen om de temperatuur met één graad Celsius te verhogen. .
De calorimetrische pomp
Het is een apparaat waarin de hoeveelheid warmte die vrijkomt of wordt geabsorbeerd in een reactie die optreedt bij een constant volume wordt gemeten.
De reactie vindt plaats in een sterk stalen vat (de pomp), dat is ondergedompeld in een grote hoeveelheid water. Dit maakt de veranderingen in de watertemperatuur klein. Daarom wordt aangenomen dat de veranderingen die zijn geassocieerd met de reactie worden gemeten bij constante temperatuur en volume.
Het bovenstaande geeft aan dat er geen werk wordt verricht wanneer een reactie wordt uitgevoerd in een calorimetrische pomp.
De reactie begint met het leveren van elektriciteit via kabels die op de pomp zijn aangesloten.
De adiabatische calorimeter
Het wordt gekenmerkt door een isolerende structuur die een schild wordt genoemd. Het schild bevindt zich rond de cel waar warmte en temperatuurveranderingen optreden. Het is ook verbonden met een elektronisch systeem dat zijn temperatuur zeer dicht bij die van de cel houdt, om warmteoverdracht te voorkomen.
In een adiabatische calorimeter wordt het temperatuurverschil tussen de calorimeter en zijn omgeving geminimaliseerd; evenals het minimaliseren van de warmteoverdrachtscoëfficiënt en de tijd voor warmte-uitwisseling.
Zijn delen bestaan uit het volgende:
-De cel (of container), geïntegreerd in een isolatiesysteem waarmee wordt geprobeerd warmteverlies te voorkomen.
-De thermometer om temperatuurveranderingen te meten.
-Een verwarming, verbonden met een regelbare bron van elektrische spanning.
-En het schild, al genoemd.
In dit type calorimeter kunnen eigenschappen zoals entropie, Debye-temperatuur en elektronische toestandsdichtheid worden bepaald.
De isoperibolic calorimeter
Het is een apparaat waarin de reactiecel en de pomp zijn ondergedompeld in een structuur die een mantel wordt genoemd. In dit geval bestaat de zogenaamde mantel uit water, op een constante temperatuur gehouden.
De temperatuur van de cel en de pomp stijgen als warmte vrijkomt tijdens het verbrandingsproces; maar de temperatuur van de watermantel wordt op een vaste temperatuur gehouden.
Een microprocessor regelt de temperatuur van de cel en de mantel en maakt de nodige correcties van de lekwarmte die het gevolg is van de verschillen tussen de twee temperaturen.
Deze correcties worden continu toegepast en met een laatste correctie op basis van de metingen voor en na de test.
De stroomcalorimeter
Ontwikkeld door Caliendar, heeft het een apparaat om een gas in een container met een constante snelheid te verplaatsen. Bij het toevoegen van warmte wordt de temperatuurstijging in de vloeistof gemeten.
De flow-calorimeter wordt gekenmerkt door:
- Een exacte meting van het constante debiet.
- Nauwkeurige meting van de hoeveelheid warmte die via een verwarming in de vloeistof wordt gebracht.
- Een nauwkeurige meting van de temperatuurstijging in het gas veroorzaakt door de energie-input
- Een ontwerp om de capaciteit van een gas onder druk te meten.
De calorimeter voor differentiële scanningcalorimetrie
Het wordt gekenmerkt door het hebben van twee containers: in één wordt het te onderzoeken monster geplaatst, terwijl de andere leeg wordt gehouden of een referentiemateriaal wordt gebruikt.
De twee vaten worden met een constante energiesnelheid verwarmd, door middel van twee onafhankelijke kachels. Wanneer de verwarming van de twee containers begint, zal de computer het verschil in warmtestroom van de verwarmingstoestellen afbeelden tegen de temperatuur, waardoor de warmtestroom kan worden bepaald.
Bovendien kan de variatie van de temperatuur als functie van de tijd worden bepaald; en tot slot, de calorische capaciteit.
toepassingen
In de fysiochemie
-De basiscalorimeters, type koffiekopje, maken het mogelijk de hoeveelheid warmte te meten die een lichaam afgeeft of absorbeert. Ze kunnen bepalen of een reactie exotherm of endotherm is. Bovendien kan de specifieke warmte van een lichaam worden bepaald.
-Met de adiabatische calorimeter was het mogelijk om de entropie van een chemisch proces en de elektronische dichtheid van de toestand te bepalen.
In biologische systemen
-Microcalorimeters worden gebruikt om biologische systemen te bestuderen die interacties tussen moleculen omvatten, evenals de moleculaire conformationele veranderingen die optreden; bijvoorbeeld bij het ontvouwen van een molecuul. De lijn omvat zowel differentiële scanning als isotherme titratie.
-De microcalorimeter wordt gebruikt bij de ontwikkeling van geneesmiddelen van kleine moleculen, biotherapeutica en vaccins.
Zuurstofpomp-calorimeter en calorische kracht
De verbranding van talrijke stoffen vindt plaats in de calorimeter van de zuurstofpomp en het calorische vermogen ervan kan worden bepaald. Onder de onderzochte stoffen door het gebruik van deze calorimeter zijn: steenkool en cokes; eetbare oliën, zowel zwaar als licht; benzine en alle motorbrandstoffen.
Evenals de soorten brandstoffen voor vliegtuigreactoren; brandstofafval en afvalverwerking; voedingsproducten en supplementen voor menselijke voeding; voedergewassen en voedingssupplementen; bouwmaterialen; raket en drijfgas.
Evenzo is het calorische vermogen bepaald door calorimetrie in thermodynamische studies van brandbare materialen; in de studie van energiebalans in ecologie; in explosieven en thermische poeders en in het onderwijzen van basale thermodynamische methoden.
referenties
- Whitten, Davis, Peck & Stanley. Chemie. (8e druk). CENGAGE Leren.
- González J., Cortés L. & Sánchez A. (s.f.). Adiabatische calorimetrie en zijn toepassingen. Hersteld van: cenam.mx
- Wikipedia. (2018). Calorimeter. Teruggeplaatst van: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (22 juni 2018). Calorimeter definitie in de chemie. Teruggeplaatst van: thoughtco.com
- Gillespie, Claire. (11 april 2018). Hoe werkt een calorimeter? Sciencing. Teruggeplaatst van: sciencing.com


