Chemische activering Energie Waaruit bestaat, Berekening
de chemische activeringsenergie (vanuit het oogpunt van kinetische studies) verwijst naar de minst mogelijke hoeveelheid energie die nodig is om een chemische reactie te starten. Volgens de theorie van botsingen in chemische kinetica, wordt er gezegd dat alle moleculen die in beweging zijn een bepaalde hoeveelheid kinetische energie hebben.
Dit betekent dat hoe groter de snelheid van uw beweging, hoe groter de omvang van uw kinetische energie. In deze zin kan een molecuul dat een snelle beweging draagt niet op zichzelf uit fragmenten worden opgedeeld, dus moet er een botsing tussen het en een ander molecuul plaatsvinden zodat een chemische reactie kan optreden.
Wanneer dit gebeurt - wanneer een botsing optreedt tussen de moleculen - wordt een deel van zijn kinetische energie omgezet in trillingsenergie. Evenzo, als aan het begin van het proces de kinetische energie hoog is, zullen de moleculen die deelnemen aan de botsing een zo grote vibratie presenteren dat sommige van de aanwezige chemische bindingen zullen worden verbroken..
Dit verbreken van verbindingen is de eerste stap in de transformatie van reactanten in producten; dat is, in de vorming hiervan. Aan de andere kant, als aan het begin van dit proces de kinetische energie van geringe omvang is, zal er een fenomeen van "rebound" van de moleculen zijn, waardoor ze praktisch intact zullen scheiden..
index
- 1 Waar bestaat het uit??
- 1.1 Geactiveerd complex
- 2 Hoe wordt het berekend?
- 2.1 Berekening van de activeringsenergie van een chemische reactie
- 3 Hoe beïnvloedt de activeringsenergie de snelheid van een reactie?
- 4 Voorbeelden van berekening van activeringsenergie
- 5 Referenties
Waar bestaat het uit??
Uitgaande van het concept van botsingen tussen moleculen om de eerder beschreven chemische reacties te initiëren, kan worden gezegd dat er een minimale hoeveelheid energie nodig is om een botsing te laten plaatsvinden.
Dus, als de energiewaarde lager dan het vereiste minimum is, gewoon zal geen verandering tussen moleculen te zijn na de indiening van de botsing, wat betekent dat wanneer deze energie afwezig is, de betrokken soort grotendeels intact blijven en zal niet gebeuren elke verandering als gevolg van deze schok.
In deze volgorde van ideeën wordt de minimale energie die nodig is om een verandering te laten plaatsvinden na een botsing tussen moleculen activeringsenergie genoemd.
Met andere woorden, de moleculen die betrokken zijn bij een schok moeten een hoeveelheid totale kinetische energie hebben met een magnitude gelijk aan of groter dan de activeringsenergie zodat een chemische reactie kan optreden.
Ook komen in veel gevallen de moleculen met elkaar in botsing en ontstaan er een nieuwe soort, het zogenaamde geactiveerde complex, een structuur die ook wel 'overgangstoestand' wordt genoemd omdat deze slechts tijdelijk bestaat.
Het wordt veroorzaakt door de reactantsoort als gevolg van de botsing en voorafgaand aan de vorming van de producten van de reactie.
Geactiveerd complex
Het hierboven genoemde geactiveerde complex vormt een soort met een zeer lage stabiliteit maar die op zijn beurt een grote hoeveelheid potentiële energie heeft.
Het volgende diagram toont de transformatie van reactanten naar producten, uitgedrukt in termen van energie en erop wijzend dat de grootte van de energie van het geactiveerde complex dat wordt gevormd aanzienlijk groter is dan die van de reactanten en producten..
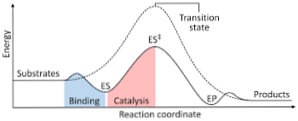
Als aan het einde van de reactie de producten een grotere stabiliteit hebben dan de reagensstoffen, treedt de afgifte van energie op in de vorm van warmte, waardoor een exotherme reactie wordt verkregen..
Integendeel, als de reactanten resulteren in een stabiliteit van grotere omvang dan de producten, betekent dit dat het reactiemengsel een absorptie van energie in de vorm van warmte uit zijn omgeving manifesteert, resulterend in een endotherme reactie..
Evenzo, als het ene geval of het andere optreedt, moet een diagram worden geconstrueerd, zoals het eerder getoonde, waarin de potentiële energie van het systeem dat reageert tegen de voortgang of voortgang van de reactie wordt uitgezet..
Op deze manier worden de potentiële energieveranderingen die plaatsvinden wanneer de reactie plaatsvindt, verkregen en worden de reactanten omgezet in producten.
Hoe wordt het berekend?
De activeringsenergie van een chemische reactie hangt nauw samen met de snelheidsconstante van die reactie, en de afhankelijkheid van deze constante op de temperatuur wordt vertegenwoordigd door de Arrhenius-vergelijking:
k = Ae-Ea / RT
In deze uitdrukking k staat voor de snelheidsconstante van de reactie (die afhangt van de temperatuur) en de parameter Een het wordt frequentiefactor genoemd en het is een maat voor de frequentie van botsingen tussen verschillende moleculen.
Van zijn kant, en drukt de basis uit van de reeks van natuurlijke logaritmes. Het wordt verhoogd tot een vermogen dat gelijk is aan het negatieve quotiënt van de activeringsenergie (Ea) tussen het product als gevolg van de gasconstante (R) en de absolute temperatuur (T) van het te overwegen systeem.
Er dient te worden opgemerkt dat de frequentiefactor kan worden beschouwd als een constante in bepaalde reactiesystemen over een breed temperatuurbereik.
Deze wiskundige uitdrukking werd beweerd in eerste instantie door de Nederlands-geboren chemicus Jacobus Henricus van 't Hoff in 1884, maar die gaf wetenschappelijke validiteit en geïnterpreteerd zijn uitgangspunt was de Zweedse chemicus Svante Arrhenius oorsprong, in 1889.
Berekening van de activeringsenergie van een chemische reactie
De Arrhenius-vergelijking wijst op de directe proportionaliteit die bestaat tussen de snelheidsconstante van een reactie en de frequentie van de botsingen tussen moleculen.
Ook kan deze vergelijking op een gemakkelijkere manier worden weergegeven door de eigenschap van natuurlijke logaritmen aan elke zijde van de vergelijking toe te passen, waarbij:
ln k = ln A - Ea / RT
Bij het opnieuw ordenen van de termen om de vergelijking van een regel te verkrijgen (y = mx + b), wordt de volgende uitdrukking bereikt:
ln k = (- Ea / R) (1 / T) + ln A
Dus, bij het construeren van een grafiek van ln k tegen 1 / T een rechte lijn, waarbij ln k wordt verkregen representeert de y-coördinaat, (Ea / R) representeert de helling van de lijn (m), (1 / T) representeert de coördinaat x, en ln stelt de kruising voor met de as van de ordinaten (b).
Zoals te zien is, is de helling die resulteert uit deze berekening gelijk aan de waarde van -Ea / R Dit houdt in dat, als het gewenst is om de waarde van de activeringsenergie te verkrijgen door middel van deze uitdrukking, een eenvoudige opheldering moet worden uitgevoerd, resulterend in:
Ea = -mR
Hier kennen we de waarde van m en R is een constante gelijk aan 8,314 J / K · mol.
Hoe beïnvloedt de activeringsenergie de snelheid van een reactie?
Bij het proberen een beeld te krijgen van de activeringsenergie, kan het worden beschouwd als een barrière die niet toelaat dat er een reactie optreedt tussen de lagere energiemoleculen.
Omdat er in een veel voorkomende reactie gebeurt dat het aantal moleculen dat kan reageren behoorlijk groot is, kan de snelheid - en daarmee de kinetische energie van deze moleculen - zeer variabel zijn.
Het gebeurt meestal dat slechts een klein deel van de totaliteit van de moleculen die een botsing ervaren - die met een grotere bewegingssnelheid - voldoende kinetische energie presenteren om de grootte van de activeringsenergie te kunnen overwinnen. Dus deze moleculen zijn geschikt en in staat om deel uit te maken van de reactie.
Volgens de Arrhenius-vergelijking, het negatieve teken dat de verhouding tussen de activeringsenergie en het product van de gasconstante vooraf door de absolute temperatuur impliceert dat de snelheidsconstante afnemende presenteert met een toename in activeringsenergie, evenals een groei wanneer de temperatuur stijgt.
Voorbeelden van berekening van activeringsenergie
De activeringsenergie berekenen door het construeren van een grafiek, volgens de Arrhenius-vergelijking, moeten de snelheidsconstanten voor de ontledingsreactie van acetaldehyde werden bij vijf verschillende temperaturen en gewenst is de activeringsenergie bepalen voor de reactie, die wordt uitgedrukt als:
CH3CHO (g) → CH4(g) + CO (g)
De gegevens van de vijf metingen zijn de volgende:
k (1 / M1/2· S): 0,011 - 0,035 - 0,105 - 0,343 - 0,789
T (K): 700 - 730 - 760 - 790 - 810
Ten eerste, deze mysterie op te lossen en stelt de activeringsenergie is een grafiek van ln k bouwen versus 1 / T (y vs. x) om een rechte lijn te verkrijgen hier vandaan de helling en vind de waarde van Ea, zoals uitgelegd.
Het transformeren van de gegevens van de metingen volgens de Arrhenius-vergelijking [ln k = (- Ea / R) (1 / T) + ln A] de volgende waarden worden gevonden voor respectievelijk y en x:
ln k: (-4.51) - (-3.35) - (-2.254) - (-1.070) - (-0.237)
1 / T (K.-1): 1,43 * 10-3 - 1.37 * 10-3 - 1.32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
Van deze waarden en door middel van de wiskundige berekening van de helling - hetzij op een computer of in een rekenmachine, door middel van de uitdrukking m = (Y2-en1) / (X2-X1) of met behulp van de lineaire regressiemethode - we verkrijgen dat m = -Ea / R = -2,09 * 104 K. Dus:
Ea = (8,314 J / K · mol) (2,09 * 104 K)
= 1,74 * 105 = 1,74 * 102 kJ / mol
Om op de grafische manier andere activeringsenergieën te bepalen, wordt een vergelijkbare procedure uitgevoerd.
referenties
- Wikipedia. (N.D.). Activatie Energie. Opgehaald van en.wikipedia.org
- Chang, R. (2007). Chemie, negende editie. Mexico: McGraw-Hill.
- Britannica, E. (s.f.). Activeringsenergie. Opgehaald van britannica.com
- Moore, J.W. en Pearson, R.G. (1961). Kinetiek en mechanisme. Opgehaald uit books.google.co.ve
- Kaesche, H. (2003). Corrosion of Metals: Physicochemical Principles and Current Problems. Opgehaald uit books.google.co.ve


