Ammoniumhydroxidestructuur, eigenschappen, nomenclatuur, toepassingen
de ammoniumhydroxide is een verbinding met een NH-molecuulformule4OH of H5NIET geproduceerd door het oplossen van ammoniakgas (NH3) in water. Om deze reden ontvangt het de namen van ammoniakwater of vloeibare ammoniak.
Het is een kleurloze vloeistof met een zeer intense en scherpe geur, die niet isolerend is. Deze kenmerken hebben een directe relatie met de NH-concentratie3 opgelost in het water; concentratie die in feite een gas is, kan grote hoeveelheden van het opgelost in een klein volume water afdekken.
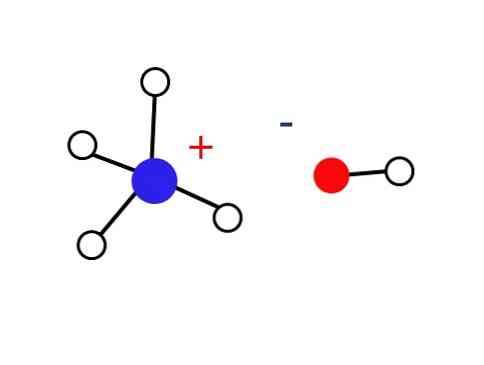
Een aanzienlijk klein deel van deze waterige oplossingen bestaat uit NH-kationen4+ en OH-anionen-. Aan de andere kant, in zeer verdunde oplossingen of in bevroren vaste stoffen bij zeer lage temperaturen kan ammoniak worden gevonden in de vorm van hydraten, zoals: NH3∙ H2O, 2NH3∙ H2O en NH3∙ 2H2O.
Als een merkwaardig feit worden de wolken van Jupiter gevormd door verdunde oplossingen van ammoniumhydroxide. De ruimtesensor van Galileo slaagde er echter niet in om water in de wolken van de planeet te vinden, wat zou worden verwacht vanuit de wetenschap dat de vorming van ammoniumhydroxide bekend is; dat wil zeggen, ze zijn NH-kristallen4OH volledig watervrij.
Het ammoniumion (NH4+) wordt geproduceerd in het renale buisvormige lumen door de vereniging van ammoniak en waterstof, afgescheiden door de niertubulaire cellen. Evenzo wordt ammonium geproduceerd in renale tubulaire cellen in het proces van transformatie van glutamine in glutamaat, en op zijn beurt in de omzetting van glutamaat in a-ketoglutaraat.
Ammoniak wordt industrieel geproduceerd volgens de Haber-Bosch-methode, waarbij de stikstof- en waterstofgassen worden omgezet; gebruik van ijzer (III) ion, aluminiumoxide en kaliumoxide als katalysatoren. De reactie wordt uitgevoerd bij hoge drukken (150 - 300 atmosfeer) en hoge temperaturen (400 - 500 ºC), met een opbrengst van 10-20%.
In de reactie wordt ammoniak geproduceerd, dat, indien geoxideerd, nitrieten en nitraten produceert. Deze zijn essentieel bij het verkrijgen van salpeterzuur en meststoffen zoals ammoniumnitraat.
index
- 1 Chemische structuur
- 1.1 Ammoniakijs
- 2 Fysische en chemische eigenschappen
- 2.1 Moleculaire formule
- 2.2 Molecuulgewicht
- 2.3 Uiterlijk
- 2.4 Concentratie
- 2.5 Geur
- 2.6 Smaak
- 2.7 Drempelwaarde
- 2.8 Kookpunt
- 2.9 Oplosbaarheid
- 2.10 Oplosbaarheid in water
- 2.11 Dichtheid
- 2.12 Dampdichtheid
- 2.13 Stoomdruk
- 2.14 Corrosieve actie
- 2.15 pH
- 2.16 Dissociatieconstante
- 3 Nomenclatuur
- 4 Oplosbaarheid
- 5 Risico's
- 5.1 Reactiviteit
- 6 Gebruik
- 6.1 In voedsel
- 6.2 Therapeutica
- 6.3 Industrieel en diversen
- 6.4 In de landbouw
- 7 Referenties
Chemische structuur
Zoals aangegeven door zijn definitie, bestaat ammoniumhydroxide uit een waterige oplossing van ammoniakgas. Daarom is er binnen de vloeistof geen gedefinieerde structuur anders dan die van een willekeurige rangschikking van NH-ionen4+ en OH- gesolvateerd door watermoleculen.
De ammonium- en hydroxylionen zijn producten van een evenwicht van hydrolyse van ammoniak, dus het is gebruikelijk dat deze oplossingen een penetrante geur hebben:
NH3(g) + H2O (l) <=> NH4+(ac) + OH-(Aq)
Volgens de chemische vergelijking zou een hoge afname in waterconcentratie het evenwicht verschuiven naar de vorming van meer ammoniak; dat wil zeggen, als het ammoniumhydroxide wordt verwarmd, zullen ammoniakdampen vrijkomen.
Om deze reden, NH-ionen4+ en OH- ze slagen er niet in om een kristal te vormen in de aardse omstandigheden, wat als consequentie brengt dat het solide NH-basispunt4OH bestaat niet.
Deze vaste stof moet alleen bestaan uit ionen die elektrostatisch met elkaar in wisselwerking staan (zoals in de afbeelding).
Ammoniak ijs
Bij temperaturen onder de 0 ° C en omringd door enorme drukken, zoals die heerst in de kernen van de ijzige manen, bevriezen ammoniak en water. Daarbij kristalliseren ze in een vast mengsel met gevarieerde stoichiometrische verhoudingen, wat het eenvoudigste NH is3∙ H2O: ammoniak-monohydraat.
Het NH3∙ H2O en de NH3∙ 2H2Of het zijn ammoniakijs, omdat de vaste stof bestaat uit een kristallijne ordening van watermoleculen en ammoniak verbonden door waterstofbruggen.
Gegeven een verandering van T en P, volgens computationele studies die alle fysische variabelen en hun effecten op dit ijs simuleren, treedt een overgang van een NH-fase op3∙ nH2Of naar een NH-fase4OH.
Daarom alleen in deze extreme omstandigheden, de NH4OH kan bestaan als een product van een protonatie in het ijs tussen de NH3 en de H2O:
NH3(s) + H2O (s) <=> NH4OH (s)
Merk op dat deze keer, in tegenstelling tot de hydrolyse van ammoniak, de betrokken soort zich in een vaste fase bevindt. Een ammoniakijs dat zout wordt zonder ammoniak vrij te geven.
Fysische en chemische eigenschappen
Moleculaire formule
NH4OH of H5NO
Moleculair gewicht
35.046 g / mol
verschijning
Het is een kleurloze vloeistof.
concentratie
Tot ongeveer 30% (voor NH-ionen4+ en OH-).
geur
Zeer sterk en scherp.
smaak
acre.
Drempelwaarde
34 ppm voor niet-specifieke detectie.
Kookpunt
38 ºC (25%).
oplosbaarheid
Het bestaat alleen in waterige oplossing.
Oplosbaarheid in water
Mengbaar in onbeperkte hoeveelheden.
dichtheid
0.90 g / cm3 bij 25 ºC.
Dampdichtheid
Ten opzichte van de lucht als eenheid: 0.6. Dat wil zeggen, het is minder dicht dan lucht. Logischerwijs heeft de gerapporteerde waarde betrekking op ammoniak als een gas, niet op zijn waterige oplossingen of op NH4OH.
Stoom druk
2.160 mmHg bij 25 ºC.
Corrosieve actie
Het is in staat zink en koper op te lossen.
pH
11,6 (oplossing 1 N); 11.1 (oplossing 0.1 N) en 10,6 (0,01 N oplossing).
Dissociatieconstante
pKb = 4,767; Kb = 1,71 x 10-5 bij 20 ºC
pKb = 4,751; Kb = 1,774 x 10-5 bij 25 º C.
De temperatuurstijging neemt bijna onmerkbaar de basiciteit van ammoniumhydroxide toe.
nomenclatuur
Wat zijn alle gebruikelijke en officiële namen die NH ontvangt?4OH? Volgens wat is vastgesteld door de IUPAC, is de naam ammoniumhydroxide omdat het het hydroxylanion bevat.
Het ammonium bij zijn lading +1 is eenwaardig, reden waarom de nomenclatuur wordt gebruikt. Het heeft de naam: ammoniumhydroxide (I).
Hoewel het gebruik van de term ammoniumhydroxide technisch incorrect is, omdat de verbinding niet isoleerbaar is (althans niet op aarde, zoals in detail in de eerste sectie wordt uitgelegd).
Bovendien ontvangt ammoniumhydroxide de namen van ammoniakwater en vloeibare ammoniak.
oplosbaarheid
Het NH4OH, omdat er geen zout is in terrestrische omstandigheden, kan niet worden geschat hoe oplosbaar het is in verschillende oplosmiddelen.
Men zou echter verwachten dat het extreem oplosbaar in water is, omdat het oplossen ervan grote hoeveelheden NH zou afgeven3. Theoretisch zou het een geweldige manier zijn om ammoniak op te slaan en te transporteren.
In andere oplosmiddelen die in staat zijn waterstofbindingen te accepteren, zoals alcoholen en aminen, zou men kunnen verwachten dat het ook daarin zeer oplosbaar zou zijn. Hier het NH-kation4+ is een donor van waterstofbruggen en de OH- het werkt als beide.
Voorbeelden van deze interacties met methanol zijn: H3N+-H - OHCH3 en HO- - HOCH3 (OHCH3 geeft aan dat zuurstof de waterstofbinding ontvangt, niet dat de methylgroep is gekoppeld aan H).
risico's
-Bij contact met de ogen veroorzaakt irritatie die kan leiden tot oogbeschadiging.
-Het is bijtend. Daarom kan bij contact met de huid irritatie veroorzaken en bij hoge concentraties van het reagens huidverbranding veroorzaken. Herhaald contact van het ammoniumhydroxide met de huid kan uitdroging, jeuk en roodheid veroorzaken (dermatitis).
-Inhalatie van een spray met ammoniumhydroxide kan acute irritatie van de luchtwegen veroorzaken, gekenmerkt door verstikking, hoesten of kortademigheid. Langdurige of herhaalde blootstelling van de stof kan resulteren in recidiverende bronchiale infecties. Ook kan de inhalatie van ammoniumhydroxide irritatie van de longen veroorzaken.
-Blootstelling aan hoge concentraties ammoniumhydroxide kan een medisch noodgeval zijn, omdat vochtophoping in de longen (longoedeem) kan optreden.
-De concentratie van 25 ppm is genomen als een blootstellingslimiet, in een 8-urige werkshift, in een omgeving waar de werknemer wordt blootgesteld aan de schadelijke werking van ammoniumhydroxide.
reactiviteit
-Daarnaast zijn er nog andere voorzorgsmaatregelen waarmee rekening moet worden gehouden bij het werken met de substantie van de potentiële gezondheidsschade door blootstelling aan ammoniumhydroxide..
-Ammoniumhydroxide kan reageren met veel metalen, zoals: zilver, koper, lood en zink. Het reageert ook met de zouten van deze metalen om explosieve verbindingen te vormen en waterstofgas vrij te maken; wat op zijn beurt ontvlambaar en explosief is.
-Het kan heftig reageren met sterke zuren, bijvoorbeeld: zoutzuur, zwavelzuur en salpeterzuur. Evenzo reageert het op dezelfde manier met dimethylsulfaat en halogenen.
-Reageert met sterke basen, zoals natriumhydroxide en kaliumhydroxide, met vorming van gasvormige ammoniak. Dit kan worden gecontroleerd als het evenwicht in oplossing wordt waargenomen, waarbij de OH-ionen worden toegevoegd- verschuift de balans naar NH-formatie3.
-Koper en aluminium metalen, evenals andere gegalvaniseerde metalen, mogen niet worden gebruikt bij het hanteren van ammoniumhydroxide, vanwege de corrosieve werking ervan..
toepassingen
In voedsel
-Het wordt gebruikt als additief in veel voedingsmiddelen waarin het fungeert als een rijsmiddel, pH-controle en afwerkmiddel van het voedseloppervlak..
-De lijst van voedingsmiddelen waarin ammoniumhydroxide wordt gebruikt, is uitgebreid en omvat gebakken goederen, kazen, chocolaatjes, snoep en puddingen.
-Ammoniumhydroxide is door de FDA geclassificeerd als een veilige stof voor de verwerking van voedsel, op voorwaarde dat de vastgestelde normen worden nageleefd.
-In vleesproducten wordt het gebruikt als een antimicrobieel middel, in staat om bacteriën zoals E. coli te elimineren en het tot niet-detecteerbare niveaus te reduceren. De bacteriën worden aangetroffen in de darm van runderen en passen zich aan de zure omgeving aan. Ammoniumhydroxide, door de pH te reguleren, belemmert de bacteriegroei.
therapeutische
-Ammoniumhydroxide heeft verschillende therapeutische toepassingen, waaronder:
-De 10% -oplossing wordt gebruikt als een ademhalingsreflexstimulans
-Extern wordt het op de huid gebruikt voor de behandeling van insectenbeten en beten - het werkt op het spijsverteringssysteem als antacidum en carminatief, dat wil zeggen het helpt de eliminatie van gassen.
Bovendien wordt het gebruikt als een actuele rubefacient voor acute en chronische musculoskeletale pijn. Als gevolg van de rubefaciënte werking van ammoniumhydroxide is er een plaatselijke toename van de bloedstroom, roodheid en irritatie.
Industrieel en diversen
-Het werkt in de reductie van NOx (zeer reactieve gassen zoals stikstofmonoxide (NO) en stikstofdioxide (NO2)) voor schoorsteenemissies en NOx-reductie in schoorsteenemissies.
-Het wordt gebruikt als weekmaker; Additief van verven en voor de behandeling van oppervlakken.
-Het verhoogt de porositeit van het haar waardoor de pigmenten van de vlek een grotere penetratie hebben, waardoor een betere afwerking wordt verkregen.
-Ammoniumhydroxide wordt gebruikt als een antimicrobieel middel bij de behandeling van afvalwater. Bovendien grijpt het in bij de synthese van chlooramine. Deze stof vervult een functie die vergelijkbaar is met chloor bij de zuivering van zwembadwater, met het voordeel dat deze minder toxisch is.
-Het wordt gebruikt als corrosieremmer bij het olieraffinageproces.
-Het wordt gebruikt als reinigingsmiddel in verschillende industriële en commerciële producten, op verschillende oppervlakken, waaronder: roestvrij staal, porselein, glas en oven.
-Bovendien wordt het gebruikt bij de productie van detergenten, zepen, farmaceutische producten en inkten.
In de landbouw
Hoewel niet direct toegediend als meststof, vervult ammoniumhydroxide deze functie. Ammonia wordt geproduceerd met atmosferische stikstof volgens de Haber-Bosch-methode en gekoeld vervoerd onder het kookpunt (-33 ° C) naar de plaatsen waar het wordt gebruikt.
De onder druk staande ammoniak wordt, in dampvorm, in de grond geïnjecteerd, waar het onmiddellijk reageert met het edafische water en overgaat in de ammoniumvorm (NH4+), die wordt vastgehouden in de kationuitwisselingsplaatsen op de bodem. Bovendien wordt ammoniumhydroxide geproduceerd. Deze verbindingen zijn een bron van stikstof.
Samen met fosfor en kalium vormt stikstof de drieklank van de belangrijkste voedingsstoffen van planten die essentieel zijn voor de groei.
referenties
- Ganong, W. F. (2002). Medische fysiologie. 19e editie. Redactioneel Modern handboek.
- A.D. Fortes, J.P. Brodholt, I.G. Wood en L. Vocadlo. (2001). Ab initio-simulatie van ammoniak-monohydraat (NH3∙ H2O) en ammoniumhydroxide (NH4OH). American Institute of Physics. J. Chem. Phys., Band 115, nr. 15, 15.
- Helmenstine, Anne Marie, Ph.D. (6 februari 2017). Ammoniumhydroxidefeiten. Teruggeplaatst van: thoughtco.com
- Pochteca Group. (2015). Ammoniumhydroxide. pochteca.com.mx
- NJ Health (N.D.). Informatieblad over gevaarlijke stoffen: ammoniumhydroxide. [PDF]. Teruggeplaatst van: nj.gov
- Chemistry Learner. (2018). Ammoniumhydroxide. Teruggeplaatst van: chemistrylearner.com
- PubChem. (2018). Ammoniumhydroxide. Teruggeplaatst van: pubchem.ncbi.nlm.nih.gov


