Wat is een verzadigde oplossing? (met voorbeelden)
een verzadigde oplossing is een chemische oplossing die de maximale concentratie opgeloste stof in een oplosmiddel bevat. Het wordt beschouwd als een toestand van dynamisch evenwicht waarbij de snelheden waarbij het oplosmiddel de opgeloste stof oplost en de snelheid van herkristallisatie gelijk zijn (J., 2014).
De extra opgeloste stof zal niet oplossen in een verzadigde oplossing en zal in een andere fase verschijnen, ongeacht of het een neerslag is als het een vaste stof in vloeistof is of als het een gas in een vloeistof is (Anne Marie Helmenstine, 2016).
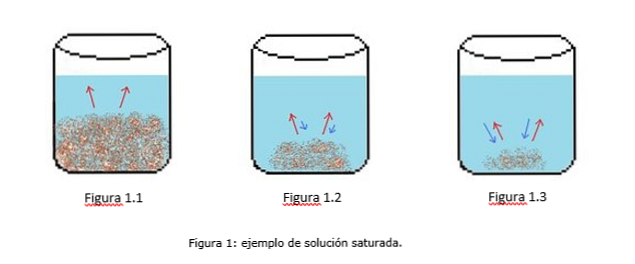
Een voorbeeld van een verzadigde oplossing is geïllustreerd in figuur 1. In figuur 1.1, 1.2 en 1.3 is er een constant volume water in de beker. In figuur 1.1 begint het verzadigingsproces, waarbij de opgeloste stof begint op te lossen, weergegeven door de rode pijlen.
In figuur 1.2 is veel van de vaste stof opgelost, maar niet volledig vanwege het rekristallisatieproces, weergegeven door de blauwe pijlen.
In figuur 1.3 blijft slechts een kleine hoeveelheid opgeloste stof onopgelost. In dit geval is de herkristallisatiesnelheid groter dan de oplossnelheid. (tips van verzadiging, 2014)
Het punt van maximale concentratie van een opgeloste stof in een oplosmiddel staat bekend als verzadigingspunt.
index
- 1 Factoren die de verzadiging beïnvloeden
- 1.1 Temperatuur
- 1.2 Druk
- 1.3 Chemische samenstelling
- 1.4 Mechanische factoren
- 2 Kleurverzadigings- en oplosbaarheidscurven
- 3 Voorbeelden van verzadigde oplossingen
- 4 Wat is een oververzadigde oplossing?
- 5 Referenties
Factoren die de verzadiging beïnvloeden
De hoeveelheid opgeloste stof die in een oplosmiddel kan worden opgelost, is afhankelijk van verschillende factoren, waarvan de belangrijkste zijn:
temperatuur
Oplosbaarheid neemt toe met de temperatuur. U kunt bijvoorbeeld meer zout oplossen in warm water dan in koud water.
Er kunnen echter uitzonderingen zijn, bijvoorbeeld dat de oplosbaarheid van de gassen in water afneemt bij toenemende temperatuur. In dit geval ontvangen opgeloste moleculen kinetische energie wanneer ze worden verwarmd, wat hun ontsnapping vergemakkelijkt.
druk
De toename in druk kan het oplossen van opgeloste stof forceren. Dit wordt vaak gebruikt om gassen in vloeistoffen op te lossen.
Chemische samenstelling
De aard van de opgeloste stof en het oplosmiddel en de aanwezigheid van andere chemische verbindingen in de oplossing beïnvloeden de oplosbaarheid. U kunt bijvoorbeeld een grotere hoeveelheid suiker in water oplossen dan zout in water. In dit geval wordt gezegd dat suiker beter oplosbaar is.
Ethanol in water is volledig oplosbaar met elkaar. In dit specifieke geval zal het oplosmiddel de verbinding zijn die in grotere hoeveelheid is.
Mechanische factoren
In tegenstelling tot de oplossnelheid, die hoofdzakelijk afhangt van de temperatuur, hangt de snelheid van herkristallisatie af van de concentratie opgeloste stof op het oppervlak van het kristallijne rooster, hetgeen de voorkeur heeft wanneer een oplossing onbeweeglijk is.
daarom, de agitatie van de oplossing vermijd deze accumulatie, maximaliserende ontbinding (tips van verzadiging, 2014).
Verzadiging en oplosbaarheid curven
De oplosbaarheidscurven zijn een grafische database waarin de hoeveelheid opgeloste stof die in een hoeveelheid oplosmiddel oplost, bij een bepaalde temperatuur wordt vergeleken.
Oplosbaarheidscurven worden gewoonlijk uitgezet voor een hoeveelheid opgeloste stof, hetzij vast of gas, in 100 gram water (Brian, 2014).
Figuur 2 illustreert de verzadigingsgrafieken voor verschillende opgeloste stoffen in water.

In de as van de coördinaten heb je de temperatuur in graden Celsius en in de as van de abscissen heb je de concentratie opgeloste stof uitgedrukt in grammen opgeloste stof per 100 gram water.
De curve geeft het verzadigingspunt bij een bepaalde temperatuur aan. Het gebied onder de curve geeft aan dat u een onverzadigde oplossing hebt en daarom kunt u meer opgeloste stoffen toevoegen.
Het gebied boven de curve heeft een oververzadigde oplossing. (Solubility Curves, s.f.)
Als u bijvoorbeeld het natriumchloride (NaCl) bij 25 graden Celsius neemt, kunt u ongeveer 35 gram NaCl in 100 gram water oplossen om een verzadigde oplossing te verkrijgen. (Cambrige University, s.f.)
Voorbeelden van verzadigde oplossingen
Verzadigde oplossingen zijn van dag tot dag te vinden, het is niet nodig om in een chemisch laboratorium te zijn. Het oplosmiddel hoeft niet noodzakelijk water te zijn. Hieronder zijn dagelijkse voorbeelden van verzadigde oplossingen:
-Soda en frisdranken in het algemeen zijn oplossingen verzadigd met koolstofdioxide in water. Dat is de reden waarom, wanneer de druk wordt vrijgegeven, koolstofdioxide-bellen worden gevormd.
-Aarden bodem is verzadigd met stikstof.
-Je kunt suiker of zout toevoegen aan azijn om een verzadigde oplossing te vormen.
-Voeg chocoladepoeder toe om te melken totdat het niet oplost en een verzadigde oplossing vormt.
-Melk kan zodanig met bloem worden verzadigd dat er geen meel meer aan de melk kan worden toegevoegd.
-De gesmolten boter kan verzadigd zijn met zout, als het zout niet meer oplost.
Wat is een oververzadigde oplossing?
De definitie van een oververzadigde oplossing is er een die meer opgeloste opgeloste stof bevat dan normaal zou worden opgelost in het oplosmiddel. Dit wordt meestal gedaan door de temperatuur van de oplossing te verhogen.
Een kleine wijziging van de oplossing of introductie van een "zaadje" of een klein kristal van opgeloste stof zal de kristallisatie van de overmaat opgeloste stof dwingen. Als er geen nucleatiepunt is voor kristalvorming, kan de overtollige opgeloste stof in oplossing blijven.
Een andere vorm van oververzadiging kan optreden wanneer een verzadigde oplossing zorgvuldig wordt gekoeld. Deze verandering in omstandigheden betekent dat de concentratie eigenlijk groter is dan het verzadigingspunt, de oplossing is oververzadigd.
Dit kan worden gebruikt in het herkristallisatieproces om een chemische stof te zuiveren: het lost op tot het punt van verzadiging in heet oplosmiddel, en wanneer het oplosmiddel afkoelt en de oplosbaarheid afneemt, precipiteert de overmaat opgeloste stof.
De onzuiverheden, die in een veel lagere concentratie aanwezig zijn, verzadigen het oplosmiddel niet en blijven dus opgelost in de vloeistof.
Referenties
- Anne Marie Helmenstine, P. (2016, 7 juli). Verzadigde oplossingsdefinitie en voorbeelden. Teruggeplaatst van ongeveer: about.com
- Cambrige University. (N.d.). Oplosbaarheidscurven. Opgehaald van dynamicscience.com: dynamicscience.com.au.
- Voorbeelden van verzadigde oplossing. (N.D.). Teruggevonden uit je agenda: examples.yourdictionary.com.
- , S. (2014, 4 juni). Verzadigde en oververzadigde oplossingen. Opgehaald van socratic.org: socratic.org.
- James, N. (s.f.). Verzadigde oplossing: definitie en voorbeelden. Opgehaald van study.com: study.com.
- , B. (2014, 14 oktober). Verzadigde en oververzadigde oplossingen. Opgehaald van socratic.org: socratic.org.
- Oplosbaarheidscurves. (N.D.). Teruggehaald van KentChemistry: kentchemistry.com.
- Tips voor verzadiging. (2014, 26 juni). Teruggewonnen van scheikunde libretex: chem.libretexts.org.


