Exothermisch reactieproces, typen en voorbeelden
de exotherme reactie is een soort chemische reactie waarbij een energieoverdracht plaatsvindt, voornamelijk in de vorm van warmte- of lichtafgifte. De naam komt van het Griekse voorvoegsel exo, wat "in het buitenland" betekent; en de term "thermisch", die verwijst naar warmte of temperatuur.
In die zin kunnen exotherme reacties andere soorten energie overbrengen naar de omgeving waar ze worden gegenereerd, zoals met explosies en de manier waarop ze kinetische en sonische energie overbrengen wanneer stoffen die zich bij hoge temperaturen in de gasfase bevinden worden uitgebreid. gewelddadige manier.
Op dezelfde manier, in het geval van het gebruik van batterijen, wordt ook een exotherme reactie uitgevoerd, alleen in dit geval wordt elektrische energie getransporteerd.
index
- 1 Proces
- 2 soorten
- 2.1 Verbrandingsreacties
- 2.2 Neutralisatiereacties
- 2.3 Oxidatiereacties
- 2.4 Termietreactie
- 2.5 Reactiepolymerisatie
- 2.6 Kernsplijting
- 2.7 Andere reacties
- 3 voorbeelden
- 4 Referenties
procédé
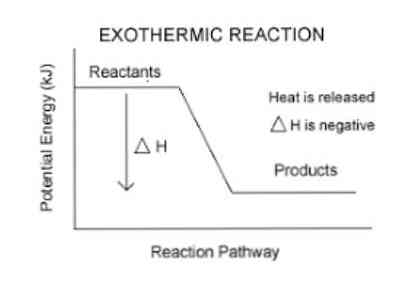
Eerder werd vermeld dat wanneer een exotherme reactie optreedt, er een energievrijstelling optreedt, die gemakkelijker kan worden gevisualiseerd in de volgende vergelijking:
Reagentia (s) → Product (en) + Energie
Om de door een systeem geabsorbeerde of vrijgegeven energie te kwantificeren, wordt dus een thermodynamische parameter genaamd enthalpie (aangeduid met "H") gebruikt. Als in een systeem (in dit geval een chemische reactie) er energie wordt vrijgegeven aan de omgeving, zal de variatie van de enthalpie (uitgedrukt als ΔH) een negatieve waarde hebben.
Anders, als de variatie van deze maat positief is, geeft deze de opname van warmte uit de omgeving weer. Ook is de grootte van de enthalpie-variatie van het systeem een uitdrukking van de hoeveelheid energie die wordt overgebracht naar of van de omgeving..
Hoe groter de omvang van ΔH, des te groter de vrijgave van energie van het systeem naar het omringende medium.
Dit komt omdat in deze reacties de netto energie die vrijkomt wanneer nieuwe verbindingen worden gemaakt groter is dan de netto energie die wordt gebruikt in de fragmentatie van de links.
Uit het bovenstaande kan worden afgeleid dat dit soort reacties zeer gebruikelijk is, omdat de producten van de reactie een hoeveelheid energie bevatten die is opgeslagen in de bindingen die groter is dan wat zich in de reactanten bevindt..
type
Er zijn verschillende soorten exotherme reacties op de verschillende gebieden van de chemie, zowel in het laboratorium als in de industrie; sommige worden spontaan uitgevoerd en andere hebben specifieke omstandigheden of een bepaald type stof nodig, zoals een te produceren katalysator.
De volgende zijn de belangrijkste soorten exotherme reacties:
Verbrandingsreacties
De verbrandingsreacties zijn die van het redox-type die optreden wanneer een of meer stoffen reageren met zuurstof, in het algemeen om te resulteren in de afgifte van licht en thermische energie - dat wil zeggen licht en warmte - wanneer een vlam wordt geproduceerd..
Neutralisatiereacties
Neutralisatiereacties worden gekenmerkt door de interactie tussen een zure verbinding en een alkalische stof (base) om een zout en water te vormen, die een exotherme werking hebben.
Oxidatiereacties
Er zijn veel reacties van dit type die een exotherm gedrag vertonen, omdat de oxidatie van zuurstof de afgifte van een grote hoeveelheid energie veroorzaakt, zoals optreedt bij de oxidatie van koolwaterstoffen..
Termietreactie
Deze reactie kan een temperatuur van ongeveer 3000 ° C produceren en vanwege de hoge affiniteit van aluminiumpoeder met een groot aantal metaaloxiden, wordt het gebruikt bij het lassen van staal en ijzer.
Polymerisatiereactie
Dit type reactie is degene die ontstaat wanneer een bepaald aantal chemische soorten, monomeren genaamd, reageert. Dit zijn eenheden die in combinatie worden herhaald in ketens om macromoleculaire structuren te vormen, polymeren genaamd.
Kernsplijting
Dit proces verwijst naar de deling van de kern van een atoom dat als zwaar wordt beschouwd - dat wil zeggen, met een massagetal (A) groter dan 200 - om fragmenten of kernen van kleinere omvang te produceren met een tussenliggende massa.
In deze reactie, waar een of meer neutronen worden gevormd, komt een grote hoeveelheid energie vrij omdat de kern met een groter gewicht een lagere stabiliteit heeft dan zijn producten.
Andere reacties
Er zijn ook andere exotherme reacties van groot belang, zoals dehydratie van sommige koolhydraten bij het reageren met zwavelzuur, de absorptie van water dat natriumhydroxide heeft blootgesteld aan de open lucht of de oxidatie van metaalsoorten bij veel corrosiereacties.
Voorbeelden
Hieronder volgen enkele voorbeelden van exotherme reacties, die een enthalpie-variatie produceren die een negatieve waarde heeft vanwege het feit dat ze energie afgeven, zoals hierboven vermeld..
De verbranding van propaan is bijvoorbeeld een spontane exotherme reactie:
C3H8(g) + 502(g) → 3CO2(g) + 4H2O (l)
Een ander geval van exotherm gedrag wordt aangetoond door de neutralisatiereactie tussen natriumcarbonaat en zoutzuur:
NaHCO3(ac) + HCl (ac) → NaCl (ac) + H2O (l) + CO2(G)
De oxidatie van ethanol tot azijnzuur gebruikt in de blaaspijpen wordt ook gepresenteerd, waarvan de volledige reactie wordt getoond in de volgende vergelijking:
3CH3CH2OH + 2K2Cr2O7 + 8H2SW4 → CH3COOH + 2Cr (SO4)3 + 2K2SW4 + 11H2O
Een andere klasse van exotherme reactie is de zogenaamde thermietreactie, waarbij aluminium wordt gecombineerd met een metaaloxide, zoals hieronder geïllustreerd:
2Al (s) + Geloof2O3(s) → Al2O3(s) + Fe (l)
Naast de hierboven toegelichte voorbeelden, is er een grote verscheidenheid aan reacties die ook als exotherm worden beschouwd, zoals de afbraak van bepaalde organische afvalstoffen voor compostering..
Het benadrukt ook de oxidatie van luciferinepigment door de werking van het enzym luciferase om de bioluminescentiekarakteristiek van vuurvliegjes te produceren, en zelfs ademhaling, naast vele andere reacties.
referenties
- Wikipedia. (N.D.). Exotherme reactie. Teruggehaald van es.wikipedia.org
- BBC. (N.D.). Energieveranderingen en omkeerbare reacties. Opgehaald van bbc.co.uk
- Chang, R. (2007). Chemie, negende editie. (McGraw-Hill).
- Walker, D. (2007). Chemische reacties. Opgehaald uit books.google.co.ve
- Saunders, N. (2007). Chemische reacties onderzoeken. Opgehaald uit books.google.co.ve


