Koper sulfide eigenschappen, risico's en toepassingen
de kopersulfiden beschrijf een familie van chemische verbindingen en mineralen met de formule CuXSen. Deze verbindingen omvatten economisch belangrijke mineralen en synthetische materialen.
De meest prominente kopersulfidemineralen omvatten kopersulfide (I) of cupro-sulfide, van chemische formule.2S gevonden in het mineraal calcosine en kopersulfide (II) of kopersulfide, van CuS-formule gevonden in het covelietmineraal.
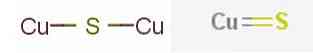
Calcosine is al eeuwenlang gewonnen en is een van de meest winstgevende kopererts. De redenen zijn te wijten aan het hoge kopergehalte (atoomverhouding van 67% en bijna 80% qua gewicht) en het gemak waarmee koper kan worden gescheiden van zwavel.
Het is echter niet het belangrijkste kopermineraal vanwege zijn schaarste. Hoewel de rijkste calcosine-afzettingen zijn gedolven, wordt deze waarschijnlijk nog steeds gewonnen en zal deze zeker in de toekomst worden gedolven (THE MINERAL CHALCOCITE, 2014).

Covelite is geen gedistribueerd mineraal, maar de iriserende charmes kunnen de bewondering van iedereen die de indigo blauwe kristallen ziet boeien. Hoewel goede kristallen zeldzaam zijn, is het de glans en kleur van dit mineraal dat het opmerkelijk maakt (THE MINERAL COVELLITE, 2014).

In de mijnindustrie worden borniet- of chalcopyrite-mineralen, die bestaan uit gemengde koper- en ijzersulfiden, vaak "kopersulfiden" genoemd.
In de chemie is een "binair kopersulfide" elke binaire chemische verbinding van de elementen koper en zwavel. Wat de bron ook is, kopersulfiden variëren sterk in samenstelling met 0,5 ≤ Cu / S ≤ 2, inclusief talrijke niet-stoichiometrische verbindingen.
index
- 1 Fysische en chemische eigenschappen van kopersulfiden
- 2 Reactiviteit en gevaren
- 3 Gebruik
- 4 Referenties
Fysische en chemische eigenschappen van kopersulfiden
Het kopersulfide (I) en (II) hebben vergelijkbare verschijningsvormen, zijnde beide kristallen donker, grijs of zwart.

Deze verbindingen kunnen worden gedifferentieerd door hun kristallijne structuur. Kopersulfide (I) heeft een monokliene structuur, terwijl koper (II) sulfide een hexagonale structuur heeft (National Center for Biotechnology Information, S.F.).
Ze hebben een molecuulgewicht van 159,16 g / mol en 95.611 g / mol en een dichtheid van 5.6 g / ml en 4.76 g / ml voor respectievelijk kopersulfide (I) en (II) (Nationaal Centrum voor Biotechnology Information, SF).
Kopersulfide (I) heeft een smeltpunt van 1100 ° C en is onoplosbaar in water en azijnzuur, dat gedeeltelijk oplosbaar is in ammoniumhydroxide (Royal Society of Chemistry, 2015).
Kopersulfide (II) een smeltpunt van 220 ° C waar het ontleedt, onoplosbaar in water, zoutzuur en zwavelzuur en oplosbaar in salpeterzuur, ammoniumhydroxide en kaliumcyanide (Royal Society of Chemistry, 2015 ).
Waterstofperoxide reageert heftig met koper (II) sulfide en explodeert bij contact met een geconcentreerde oplossing van chloorzuur of cadmium-, magnesium- of zinkchloraten.
Reactiviteit en gevaren
De kopersulfiden (I) en (II) zijn niet geclassificeerd als gevaarlijk, maar ze kunnen giftig zijn als ze worden ingeslikt door de productie van waterstofsulfide. Symptomen zijn onder meer braken, maagpijn en duizeligheid, kan irritatie aan de huid en ogen en inademing kan irritatie veroorzaken aan de luchtwegen (Material Safety Data Sheet kopersulfide, 1995).
In het geval van blootstelling aan hitte, kan het giftige dampen afgeven van zwavel of koperoxide die schadelijk kunnen zijn voor de gezondheid.
In geval van contact met de ogen, moeten ze onmiddellijk worden afgespoeld met een voldoende hoeveelheid water gedurende 15 minuten, waarbij de onderste en bovenste oogleden af en toe worden opgetild..
In geval van contact met de huid, onmiddellijk gedurende 15 minuten met voldoende water spoelen en verontreinigde kleding verwijderen..
In geval van inslikken, moet onmiddellijk een antigifcentrum worden geroepen. Spoel de mond met koud water en geef het slachtoffer 1-2 kopjes water of melk te drinken. Braken moet onmiddellijk worden geïnduceerd.
In geval van inademing moet het slachtoffer naar een koele plaats worden gebracht. Als het niet ademt, kunstmatige ademhaling geven (Copper (II) Sulfide, 2009).
toepassingen
Kopersulfide (I) wordt gebruikt als een halfgeleider en in fotografische toepassingen (americanelements, 1998-2017). De toepassingen omvatten ook het gebruik in zonnecellen, lichtgevende verven, elektroden en bepaalde variëteiten van vaste smeermiddelen (Britannica, 2013).
Bovendien kopersulfide (II) vindt toepassingen in zonnecellen, superionic geleiders, fotodetectoren, elektrisch geleidende elektroden, inrichtingen fotothermische omzetting beschermlaag microgolfabsorberende actieve radiogolf, gassensoren en polarisatoren straling infrarood (azom, 2013).
Ook wordt koper (II) sulfide (covelite) gebruikt in de studie van nanodeeltjes:
- Met verschillende productieprocedures (solvothermische routes, aerosolmethoden, oplossingsmethoden en thermolyse)
- En toepassingen (fotokatalytische afbraak ablatie van kankercellen, elektrodemateriaal in lithiumionbatterijen en gassensor, veldemissie-eigenschappen, toepassingen supercondensatoren, foto-elektrochemische prestaties QDSCs fotokatalytische reductie van organische verontreinigingen, bio- elektrochemische detectie, verbeterde PEC-kenmerken van voorgekookte CuS-filmelektroden) (Umair Shamraiz, 2016).
Werkenden Geng Ku (2012) het gebruik van nanodeeltjes van kopersulfide halfgeleider (CuS NP) voor het weergeven fotoakoestische tomografie met een Nd bewezen: YAG met een golflengte van 1064 nm.
De CuS NP toegestane visualisatie van de muizenhersenen intracraniale injectie, lymfeklieren rat tot 12 mm onder de huid na interstitiale injectie en agarosegel die CuS NP ingebed in spierweefsel Kipfilet op een diepte van ~ 5 cm. Deze beeldaanpak heeft een groot potentieel voor het verkrijgen van een moleculair beeld van borstkanker.
referenties
- (1998-2017). Koper (I) sulfide. Opgehaald van americanelements.com.
- (2013, 19 april). Kopersulfide (CuS) halfgeleiders. Opgehaald van azom.com.
- Britannica, T.E. (2013, 23 augustus). Koper (Cu). Opgehaald van britannica.com.
- Koper (II) sulfide. (2009, 23 januari). Teruggeplaatst van onboces.org.
- Geng Ku, M. Z. (2012). Copper Sulfide Nanodeeltjes als een nieuwe klasse van fotoakoestisch contrastmiddel voor diepe weefselimaging bij 1064 nm. ACS Nano 6 (8), 7489-7496.
- MATERIAAL VEILIGHEIDSGEGEVENSBLAD Koper Sulfide. (1995, november). Teruggeplaatst van onboces.org.
- Nationaal centrum voor informatie over biotechnologie. (S.F.). PubChem Compound-database; CID = 14831. Teruggeplaatst van pubchem.ncbi.nlm.nih.gov.
- Nationaal centrum voor informatie over biotechnologie. (S.F.). PubChem Compound-database; CID = 62755. Teruggeplaatst van pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Koper (II) sulfide. Opgehaald van chemspider.com.
- Royal Society of Chemistry. (2015). Dicopper (1+) sulfide. Opgehaald van chemspider.com.
- DE MINERALE CHALCOCITE. (2014). Opgehaald van galleries.com.
- DE MINERALE COVELLITE. (2014). Opgehaald van galleries.com.
- Umair Shamraiz, R. A. (2016). Fabricage en toepassingen van kopersulfide (CuS) nanostructuren. Journal of Solid State Chemistry Volume 238, 25-40.


