Natriumsulfide Formules, Gebruik, Risico's
de natriumsulfide (Na2S) is een kristallijne vaste stof van geel tot steenrood. In de natuur wordt het aangetroffen in verschillende graden van hydratatie, het meest voorkomende het natriumsulfide nonahydraat (Na2S · 9H2O).
Het zijn wateroplosbare zouten die sterk alkalische oplossingen geven. Bij blootstelling aan vochtige lucht nemen ze vocht uit de lucht op, dat spontaan kan opwarmen en ontsteking van nabijgelegen brandbare materialen kan veroorzaken. Evenzo stoten ze in contact met vochtige lucht waterstofsulfide uit, dat naar rotte eieren ruikt.

Het zijn sterke reductiemiddelen. Deze stoffen kunnen gevaarlijk zijn voor het milieu, met name voor waterorganismen.
Natriummonosulfide is in de handel verkrijgbaar in de vorm van vlokken die 60-62% Na bevatten2S ...
- formules

- CAS: 1313-82-2 Natriumsulfide (watervrij)
- CAS: 1313-84-4 Natriumsulfide (niet gehydrateerd)
2D-structuur
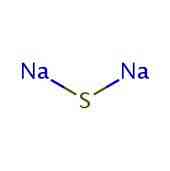
3D-structuur
Kenmerken van natriumsulfide
Fysische en chemische eigenschappen

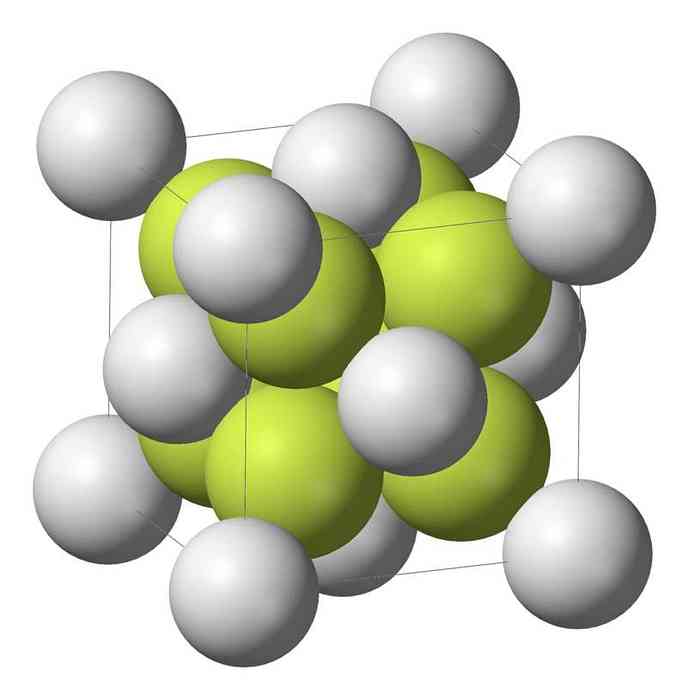
Natrium sulfide (Na2S) kristalliseert met antifluorite structuur, waarbij elke S-atoom omgeven door een naaf 8 Na-atomen en elke Na-atoom door een tetraëder van vier S-atomen.
ontvlambaarheid
Het enige licht ontvlambare onderdeel in de groep van anorganische sulfiden is waterstofsulfide. Sommige andere anorganische sulfiden, zoals natriumsulfide, kunnen spontaan opwarmen en zelfs ontbranden als ze aan vocht worden blootgesteld..
Bij blootstelling aan vuur, geeft natriumsulfide gassen of dampen van zwaveldioxide af, die irriterend of toxisch zijn.
reactiviteit
- Anorganische sulfiden zijn over het algemeen basisch (sommige zijn sterk basisch en daarom onverenigbaar met zuren).
- Veel van deze verbindingen zijn reductiemiddelen (ze reageren heftig met oxidatiemiddelen).
- Eenvoudige zouten van sulfiden (zoals natrium, kalium en ammoniumsulfide) reageren krachtig met zuren om zeer giftig en ontvlambaar waterstofsulfidegas vrij te maken.
- Natriumsulfide is ontvlambaar. Kan ontploffen bij snel verwarmen of slaan.
- Bij verhitting tot ontbinding geeft het giftige dampen van natriumoxide en zwaveloxiden af.
- Reageert hevig met koolstof, met houtskool, diazoniumzouten, N, N-dichloormethylamine, sterk oxiderende stoffen en water.
toxiciteit
Veel leden van de groep anorganische sulfiden gedragen zich als een sterke basis en kunnen ernstige brandwonden veroorzaken wanneer ze in contact komen met de huid.
Deze eigenschap is afhankelijk van de oplosbaarheid. De meest onoplosbare anorganische sulfiden (bijvoorbeeld kwik (II) sulfide en cadmiumsulfide) zijn niet bijtend.
Natriumsulfide heeft een octanol / water verdelingscoëfficiënt (Pow) medium (-3,5). Deze waarde wordt gebruikt als een maat voor de oplosbaarheid (en bioconcentratie) van een stof in dierlijke vetweefsels (vooral waterdieren).
Natriumsulfide wordt als gevaarlijk voor het milieu beschouwd, met name voor waterorganismen.
toepassingen
Thuis wordt natriumsulfide gebruikt voor het blootleggen van pijpen, huishoudelijke schoonmaakmiddelen (voor de oven, de badkamer), stijltangen, afwasmiddel en automatische airbags.
In de industrie wordt het gebruikt in reinigingsmiddelen, in cement en als een voorloper in de productie van andere chemische producten.
Klinische effecten
Blootstelling aan natriumsulfide is gebruikelijk in ontwikkelde en onderontwikkelde landen, zowel in de industrie als thuis. Deze bijtende stoffen zijn aanwezig in verschillende huishoudelijke producten in lage concentratie.
In de ontwikkelde landen zijn ernstige effecten zeldzaam. Deze komen vooral voor door opzettelijke inname van de chemische stof bij volwassenen. In ontwikkelingslanden zijn echter ernstige gevolgen vaker voorkomend.
Alkalische bijtende stoffen veroorzaken necrose als gevolg van liquefactie. Versterk de vetten in het celmembraan, vernietig de cel en laat diepe penetratie in het weefsel van de slijmvliezen toe.
Orale blootstelling
Eerste ontsteking treedt op in het maagdarmweefsel, gevolgd door weefselnecrose (met mogelijke perforatie), daarna granulatie en tenslotte stenoseformatie.
Patiënten met lichte ingestie ontwikkelen irritatie of graad I-brandwonden (oppervlakkige hyperemie en oedeem) van de orofarynx, slokdarm of maag.
Patiënten met matige intoxicatie kunnen graad II-brandwonden ontwikkelen (oppervlakkige blaasjes, erosies en ulceraties) met mogelijk verdere stenose-vorming (in het bijzonder slokdarmkanker).
Sommige patiënten (vooral jonge kinderen) kunnen oedeem in de bovenste luchtwegen ontwikkelen.
Patiënten met ernstige orale toxiciteit kan diepe brandwonden en necrose van de gastrointestinale mucosa, complicaties zoals perforatie (slokdarm, maag, twaalfvingerige zeldzaam tijd), fistels (tracheo, aortoesophageal) en gastrointestinale bloeden ontwikkeling.
kunnen hypotensie, tachycardie, tachypneu, de vorming van vernauwing (voornamelijk slokdarm), slokdarm carcinoom en oedeem van de bovenste luchtwegen (wat gebruikelijk is en vaak levensbedreigende) ontwikkelen.
Ernstige vergiftiging is over het algemeen beperkt tot opzettelijke innames bij volwassenen.
Blootstelling door inademing
Milde blootstelling kan hoesten en bronchospasmen veroorzaken.
Ernstige inademing kan oedeem in de bovenste luchtwegen, brandwonden, stridor en, in zeldzame gevallen, acute longbeschadiging veroorzaken.
Oogblootstelling
Het kan ernstige conjunctivale irritatie en chemose veroorzaken, corneale epitheliale defecten, limbische ischemie, permanent visueel verlies en in ernstige gevallen van perforatie..
Blootstelling aan de huid
Milde blootstelling veroorzaakt irritatie en brandwonden van gedeeltelijke dikte. Metabole acidose kan zich ontwikkelen bij patiënten met ernstige brandwonden of shock.
Langdurige blootstelling of producten met een hoge concentratie kunnen brandwonden van volledige dikte veroorzaken.
Beveiliging en risico's
Gevaaraanduidingen van het wereldwijd geharmoniseerd systeem voor classificatie en etikettering van chemische stoffen (SGA)
Het wereldwijd geharmoniseerd systeem voor classificatie en labeling van chemicaliën (SGA) is een internationaal overeengekomen systeem, opgezet door de Verenigde Naties en ontworpen om de verschillende classificatie- en etiketteringsstandaarden in verschillende landen te vervangen door wereldwijd consistente criteria te gebruiken.
Gevarenklassen (en de bijbehorende hoofdstuk van de GHS) criteria voor de indeling en etikettering en aanbevelingen voor natriumsulfide zijn (European Chemicals Agency, 2017, de Verenigde Naties, 2015; PubChem, 2017):







referenties
- Benjah-bmm27, (2006). Fluoriet-eenheid-cel-3D-ionisch [afbeelding] Verkregen uit: wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [afbeelding] Geïnteresseerd in: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D-structuur van 1313-82-2 - Natriumsulfide [afbeelding] Geïnteresseerd in: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D-structuur van 1313-84-4 - Natriumsulfide [afbeelding] Geïnteresseerd in: chem.nlm.nih.gov.
- Europees Agentschap voor chemische stoffen (ECHA). (2017). Samenvatting van classificatie en etikettering.
- Geharmoniseerde indeling - Bijlage VI van Verordening (EG) nr. 1272/2008 (CLP-verordening). Natriumsulfide. Opgeruimd op 16 januari 2017, op: echa.europa.eu.
- Europees Agentschap voor chemische stoffen (ECHA). (2017). Samenvatting van classificatie en etikettering.
- Aangemelde classificatie en etikettering. Natriumsulfide, gehydrateerd. Opgeruimd op 16 januari 2017, op: echa.europa.eu.
- Databank Gevaarlijke Stoffen (HSDB). TOXNET. (2017). Natriumsulfide. Bethesda, MD, EU: National Library of Medicine. Teruggeplaatst van: toxnet.nlm.nih.gov.
- Lange, L., & Triebel, W. (2000). Sulfiden, polysulfiden en sulfanen. In Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag GmbH & Co. KGaA. Teruggeplaatst van dx.doi.org.
- Verenigde Naties (2015). Globaal geharmoniseerd systeem voor classificatie en etikettering van chemische producten (SGA) Zesde herziene editie. New York, Verenigde Staten: publicatie van de Verenigde Naties. Teruggeplaatst van: unece.org.
- Nationaal centrum voor informatie over biotechnologie. PubChem Compound-database. (2016). Natriumsulfide-enneahydraat - PubChem-structuur [afbeelding] Geïnteresseerd in: pubchem.ncbi.nlm.nih.gov.
- Nationaal centrum voor informatie over biotechnologie. PubChem Compound-database. (2017). Natriummonosulfide. Bethesda, MD, EU: National Library of Medicine. Teruggeplaatst van: pubchem.ncbi.nlm.nih.gov.
- Nationaal centrum voor informatie over biotechnologie. PubChem Compound-database. (2017). Natriumsulfide-enneahydraat. Bethesda, MD, EU: National Library of Medicine. Teruggeplaatst van: pubchem.ncbi.nlm.nih.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Chemisch gegevensblad. Natriumsulfide, watervrij. Silver Spring, MD. EU; Teruggeplaatst van: cameochemicals.noaa.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Reactive Group Datasheet. Sulfiden, anorganisch. Silver Spring, MD. EU; Teruggeplaatst van: cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [afbeelding] Geïnteresseerd in: wikipedia.org.
- PubChem, (2016). Natriummonosulfide [afbeelding] Geïnteresseerd in: puchem.nlm.nih.gov.
- PubChem, (2016). Natriumsulfide-enneahydraat [afbeelding] Verkregen van: puchem.nlm.nih.gov.
- Wikipedia. (2017). Octanol-water verdelingscoëfficiënt. Opgehaald 17 januari 2017, van: wikipedia.org.
- Wikipedia. (2017). Natriumsulfide. Opgehaald 17 januari 2017, van: wikipedia.org.


