Mangaanoxide (MnO2) Chemische structuur, eigenschappen en toepassingen
de mangaanoxide (MnO2) is een anorganische chemische verbinding gevormd door het element mangaan met een oxidatiegetal +4 en zuurstof, die bij de vorming van oxiden een oxidatiegetal van -2 heeft. Het is ook bekend onder de namen van mangaan (IV) oxide en mangaan-anhydride.
Het is een vaste stof van donkere tot zwarte koffie. Het is in de natuur als het minerale pirolusiet, zwarte en gekristalliseerde vormende dendrieten (vertakte verlengingen). Het kan worden verkregen als een zwart residu in de reactie tussen ethyleen en kaliumpermanganaat na de vorming van glycol door de oxiderende werking van kaliumpermanganaat.

Het is erg belangrijk in de glasindustrie vanwege zijn karakter van oxidatiemiddel, omdat het de groene kleur elimineert die uit de ferroverbindingen komt en deze omzet in ferro.
index
- 1 Chemische structuur
- 2 Eigenschappen
- 3 Gebruik
- 3.1 Als een katalysator
- 4 Effecten op de gezondheid
- 5 Referenties
Chemische structuur
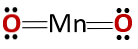
De chemische structuur van de verbinding komt overeen met die van een anhydride en niet met die van een basisch oxide, zoals zou worden verwacht omdat het uit een metaal en een niet-metaal bestaat.
Dit speciale geval is te wijten aan het gedrag dat mangaan aanneemt in de verschillende oxidatietoestanden die het heeft. Zo vormen voor de oxidatietoestand +2 en +3 de oxiden MnO en Mn2O3 respectievelijk, dat wanneer ze reageren met water, ze respectievelijk het mangaanhydroxide en mangaanhydroxide vormen.
Echter, de Mn2O3 in een licht zuur medium gedraagt het zich als een anhydride. Met de oxidatietoestanden +4, +6 en +7, de MnO2, de MnO3 en de MnO4 ze vormen zuren als ze reageren met water.
In een licht zuur medium de MnO2 het gedraagt zich als een basisch oxide, dus het kan het overeenkomstige hydroxide vormen.

Men moet niet vergeten dat in dit geval geen melding wordt gemaakt van amfotere eigenschappen, volgens welke een verbinding zich kan gedragen als een zuur of als een base. Dit is een speciaal geval van Mn-gedrag.
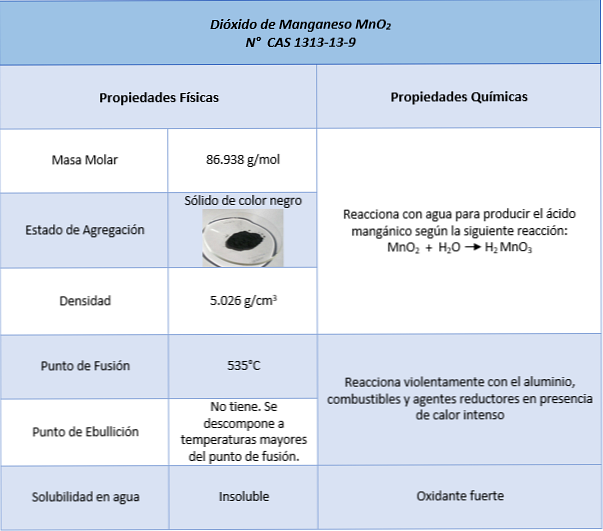
eigenschappen
toepassingen
- Het wordt gebruikt als een bron van mangaan
- Als een oxidant in alkalinebatterijen
- Verven voor glas, keramiek en porselein.
- Bij het verkrijgen van chloor en jodium.
- Bij de ontleding van waterstofperoxide voor de vorming van gasvormige zuurstof en water.
- Bij de ontledingsreactie van kaliumchloraat voor de productie van gasvormige zuurstof en kaliumchloride.
- Opgelost in aceton of in dichloormethaan, oxideert primaire alcoholen tot aldehyden en secundair aan ketonen.
- Vervaardiging van alkalinebatterijen.
Als een katalysator
Dit geldt voor oxide-reductie reacties, voor de verwijdering van sulfiden zoals H2S en kationen zoals Fe+2 en Mn+2 , arseen en radio aangetroffen in het grondwater die zijn verontreinigd met dit soort verbindingen.
Deze vervuiling kan worden veroorzaakt door ongecontroleerd storten van giftige materialen, door het wassen van vervuilde grond of door de aanwezigheid van chemische elementen op het moment van het maken van de extractie van water.
De MnO2 Hoge zuiverheid verkregen uit het pyrolusiet gebruikt als een filter (Filox) is het meest effectieve middel om deze klasse van onzuiverheden uit het grondwater te verwijderen.
Effecten op de gezondheid
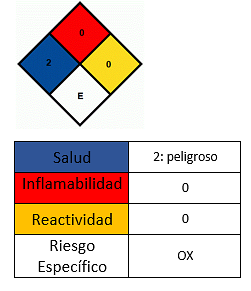
- Vermijd contact met de huid.
- In geval van contact was het overeenkomstige gebied schoon.
- Adem de poeders niet in.
- Irritatie en roodheid kunnen gezien worden bij oogcontact. Was met veel water, laat het water door de ogen stromen en bel voor medische hulp in geval van ernstige.
- Bij contact met de huid wordt irritatie en roodheid waargenomen. Was het getroffen gebied met veel water en zeep.
- Langdurig contact met de huid verwijdert uw natuurlijke vet, en veroorzaakt dermatitis.
- Inhalatie kan een griepachtige toestand veroorzaken (metaaldampen). De aandoening wordt gekenmerkt door hoge koorts, koude rillingen, droge mond en keel, spierpijn en hoofdpijn.
- Het kan de luchtwegen irriteren en de incidentie van luchtweginfecties (longontsteking) verhogen. Intoxicatie door absorptie van anorganische mangaanzouten door de longen is onwaarschijnlijk, maar chronische vergiftiging kan voorkomen.
- Chronische blootstelling aan stof of dampen van mangaandioxide gedurende een lange periode kan het centrale zenuwstelsel beïnvloeden en leiden tot de ontwikkeling van de ziekte van Parkinson, loopproblemen, spierspasmen en gedragsveranderingen.
- Inslikken kan buikpijn en misselijkheid veroorzaken.
- Het is niet brandbaar, maar het helpt om het vuur in de gloeiende materialen te verspreiden. Bij verhitting tot een temperatuur van meer dan 535 ° C ontleedt de stof tot mangaanoxide (III) Mn2O3 en zuurstof, die ontvlambaar is en het gevaar van vuur verhoogt. In dit geval moet de brand geblust worden met schuim of koolstofdioxide.
- In geval van morsen, manipuleer het middel niet zonder de juiste persoonlijke bescherming.
- Bewaar de verbinding in goed gesloten containers, op een koude en droge plaats en uit de buurt van incompatibele stoffen zoals organisch materiaal en brandbaar materiaal.
- De opslagplaats moet droog zijn en vloeren hebben die bestand zijn tegen zure corrosie en goede afvoer hebben..
- Persoonlijke beschermingsmiddelen moeten worden gebruikt, zoals handschoenen, veiligheidsbril, dampmasker, stof en rook.
referenties
- B, (2015), Manganese Dioxide, The Royal Society of Chemistry - Chemistry world, teruggevonden op chemistryworld.com
- Karal, (2014), Mangneso Dioxide, Veiligheidsinformatieblad, Hersteld van, karal.com.mx
- Je virtuele leraar (2015/02/25). Anorganische mangaanverbindingen (speciaal geval 1) - Theoretische les), opgehaald van, youtube.com
- Ecured, (s.f), Manganese Dioxide, Hersteld van ecured.cu
- Angarita G, Johnny., (2017), Manganese Dioxide: An Exceptional Technology. Hidroteco, hersteld van hydrotecocr.com
- Fernández, G., (2015), MnO Manganese Dioxide2/ aceton, Organische chemie, Hersteld van quimicaorganica.net
- Tronox, (2011), Mangaandioxide, Veiligheidsinformatieblad, Hersteld van, tronox.com


