De kenmerkende eigenschappen van materie (fysisch en chemisch)
de karakteristieke eigenschappen van materie het zijn chemische of fysische eigenschappen die kunnen helpen de ene substantie van de andere te onderscheiden of te onderscheiden. Fysieke eigenschappen zijn kenmerken van een stof die met de zintuigen worden waargenomen. Chemische eigenschappen zijn kenmerken die beschrijven hoe een stof tijdens een chemische reactie van de ene stof naar de andere verandert.
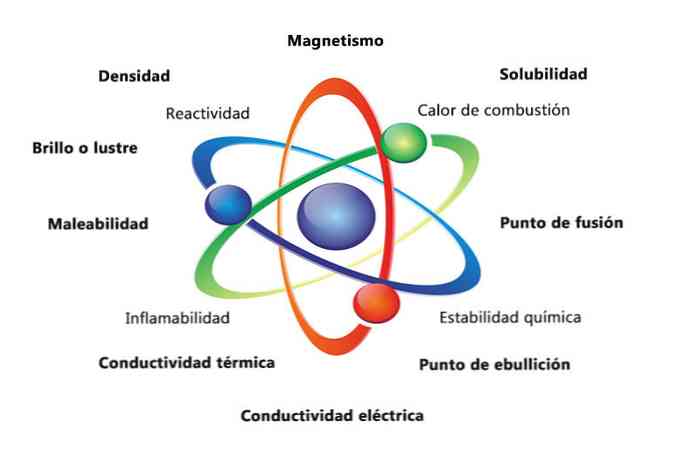
Sommige fysieke eigenschappen van een stof zijn dichtheid, oplosbaarheid, smeltpunt, kleur en massa. De chemische eigenschappen van het materiaal omvatten ontvlambaarheid, reactiviteit met zuren en corrosie. Enkele voorbeelden van hoe de eigenschappen van materie kunnen helpen een element te identificeren, is om dichtheden van verschillende elementen te vergelijken.
Een element zoals goud heeft een dichtheid van 19,3 gram per kubieke centimeter, terwijl de dichtheid van zwavel 1,96 gram per kubieke centimeter is. Evenzo zijn de smeltpunten van stoffen zoals water en isopropylalcohol verschillend.
Fysieke eigenschappen van materie
De fysieke eigenschappen van materie zijn eigenschappen die kunnen worden gemeten of waargenomen zonder de chemische aard van de stof te veranderen. Enkele voorbeelden van fysieke eigenschappen zijn:
- Densiteit: hoeveelheid materie die een object heeft, wordt berekend door de massa te delen door het volume.
- Magnetisme: de aantrekkingskracht tussen een magneet en een magnetisch object.
- Oplosbaarheid: maatstaf voor hoe goed een stof kan oplossen in een andere stof.
- Smeltpunt: temperatuur waarbij een stof verandert van vast in vloeibaar.
- Kookpunt: temperatuur waarbij een stof van vloeistof in gas verandert.
- Elektrische geleidbaarheid: is een maat voor hoe goed elektrische stromen door een substantie bewegen.
- Thermische geleiding: de snelheid waarmee een stof warmte overdraagt.
- Wendbaarheid: is het vermogen van een stof om op verschillende manieren te worden gerold of geslepen.
- Glans of glans: is hoe gemakkelijk het object licht reflecteert.
Chemische eigenschappen van materie
De chemische eigenschappen beschrijven het vermogen van een stof om zichzelf te transformeren in een nieuwe substantie met verschillende eigenschappen. Hieronder staan enkele voorbeelden van chemische eigenschappen:
- Verbrandingswarmte: wordt de energie vrijkomt wanneer een verbinding een volledige verbranding met zuurstof ondergaat.
- Chemische stabiliteit: verwijst naar of een verbinding zal reageren met water of lucht (chemisch stabiele stoffen reageren niet).
- Ontvlambaarheid: vermogen van een stof om te verbranden bij blootstelling aan een vlam.
- Reactiviteit: vermogen tot interactie met een andere stof en vormen een of meer nieuwe stoffen.
Fysieke toestanden van materie
Materie is alles dat een ruimte inneemt, dat massa heeft en dat door onze zintuigen kan worden waargenomen. Materie kan worden geclassificeerd op basis van de fysieke staat: vast, vloeibaar en gasvormig.
1- vaste stoffen en hun karakteristieke eigenschappen
Alle vaste lichamen hebben massa, nemen een spatie in beslag, hebben een gedefinieerd volume en vorm, glijden niet door de ruimte en kunnen niet worden gecomprimeerd of een stijve vorm hebben. Als voorbeelden hebben we: hout, boeken, sponzen, metaal, stenen, etc..
In vaste stoffen bevinden de kleine deeltjes materie zich heel dicht bij elkaar en raken ze elkaar. De deeltjes staan zo dicht bij elkaar dat ze niet veel kunnen bewegen, er is heel weinig ruimte tussen hen.
2- Vloeistoffen en hun karakteristieke eigenschappen
Alle vloeistoffen hebben massa, nemen een spatie in, hebben een gedefinieerd volume maar niet een gedefinieerde vorm (omdat ze zich aanpassen aan de container waarin ze zich bevinden), ze kunnen in zeer kleine mate worden gecomprimeerd en kunnen door de ruimte schuiven. Als voorbeelden hebben we: water, kerosine, olie, etc..
In vloeistoffen zijn de kleine deeltjes materie iets verder van elkaar verwijderd, er is meer ruimte tussen hen (in vergelijking met vaste stoffen) en ze raken elkaar niet. Daarom kunnen deeltjes tussen ruimtes bewegen, duwen en botsen met andere deeltjes, en constant van richting veranderen.
3- De gassen en hun karakteristieke eigenschappen
Alle gassen hebben massa, nemen een spatie in beslag, hebben geen gedefinieerd volume of vorm, kunnen in grote mate worden gecomprimeerd en kunnen in de ruimte diffunderen. Als voorbeelden hebben we: waterstof, zuurstof, stikstof, kooldioxide, stoom, etc..
In gassen bevinden de kleine deeltjes materie zich veel verder van elkaar, er is veel meer ruimte tussen hen (in vergelijking met vloeistoffen) en ze raken elkaar niet. De deeltjes hebben maximale bewegingsvrijheid, zodat ze duwen en botsen met andere deeltjes die constant van richting veranderen.
Veranderingen in de toestand van de materie
Materie kan worden omgezet van een vaste toestand naar een vloeibare toestand en omgekeerd, en van een vloeibare toestand naar een gasvormige toestand en omgekeerd. Deze conversie neemt de naam van de statusverandering aan en gebeurt door temperatuurveranderingen:
fusie
Verandering van toestand van het materiaal van vast in vloeistof door middel van de toename van de temperatuur. Wanneer een vaste stof wordt verwarmd, zorgt de warmte ervoor dat de deeltjes sterker trillen.
Bij het bereiken van het smeltpunt hebben de vaste deeltjes voldoende kinetische energie om de energetische aantrekkende krachten te overwinnen die hen op vaste posities houden, en ze breken om kleine groepen van vloeibare deeltjes te vormen..
Koken of verdampen
Verandering van toestand van de vloeibare materie naar gasvormig door middel van de toename van de temperatuur. Wanneer een vloeibare substantie wordt verwarmd, zorgt de hitte ervoor dat de deeltjes nog sneller bewegen.
Bij het bereiken van het kookpunt hebben de vloeistofdeeltjes voldoende kinetische energie om de aantrekkende krachten te overwinnen die hen in vaste posities houden en scheiden in individuele gasvormige deeltjes..
Invriezen of stollen
Verandering van toestand van de vloeibare materie in vaste stof door middel van de temperatuurafname. Wanneer een vloeibare substantie wordt afgekoeld, verliezen de deeltjes veel kinetische energie. Bij het bereiken van het vriespunt stoppen de deeltjes met bewegen en trillen op een vaste positie en worden vaste deeltjes.
Vloeibaar maken of condensatie
Verandering van toestand van het gasvormige materiaal in vloeistof door middel van de temperatuurdaling. Wanneer een gasvormige substantie wordt afgekoeld, verliezen de deeltjes veel kinetische energie waardoor ze elkaar aantrekken en vloeibare deeltjes worden.
sublimering
Sommige materialen veranderen direct van hun vaste toestand naar hun gasvormige toestand of vice versa, zonder door de vloeibare toestand te gaan. Wanneer deze vaste stoffen worden verhit, bewegen hun deeltjes zo snel dat ze volledig worden gescheiden en stoom of gas vormen, en omgekeerd wanneer het proces plaatsvindt van gasvormige naar vaste stof.
referenties
- De Podesta, M. De eigenschappen van materie begrijpen, 2e druk. Groot-Brittannië: Taylor & Francis.
- Goel A. Staten van materie. New Delhi: Discovery Publishing House.
- Moore J, Stanitski C. De moleculaire wetenschap, 5e editie. Stamford: Cengage Learning.
- Ramakrishna A. Aard van de materie, 1e editie. New Delhi: Goyal Brothers Prakashan.
- Reger D, Goode S, Ball D. Chemistry. Uitgangspunten en praktijk, 3e editie. Canada: Brooks / Cole, Cengage Learning.
- Shapere D. Matter (fysica). Teruggeplaatst van: accessscience.com.
- Singh L, Kaur M. Materie in onze omgeving. India: S. Chand School.


