Koolstof in de natuur waar het wordt gevonden en hoe, eigenschappen, toepassingen
de koolstof in de natuur het is te vinden in diamanten, olie en graffiti, en vele andere scenario's. Dit chemische element bezet de zesde plaats in het periodiek systeem en bevindt zich in de horizontale rij of periode 2 en kolom 14. Het is niet-metalen en tetravalent; dat wil zeggen, je kunt 4 chemische bindingen van gedeelde elektronen of covalente bindingen vaststellen.
Koolstof is het element met de grootste overvloed in de aardkorst. Deze overvloed, de unieke diversiteit in de vorming van organische verbindingen en het uitzonderlijke vermogen om macromoleculen of polymeren te vormen bij de temperaturen die gewoonlijk op aarde worden aangetroffen, zorgt ervoor dat het als een gemeenschappelijk element van alle bekende levensvormen dient.

Koolstof bestaat in de natuur als een chemisch element zonder te combineren in de vormen van grafiet en diamant. Voor het grootste deel wordt het echter gecombineerd om chemische koolstofverbindingen te vormen, zoals calciumcarbonaat (CaCO).3) en andere verbindingen in aardolie en aardgas.
Het vormt ook verschillende mineralen zoals antraciet, steenkool, bruinkool en turf. Het grootste belang van koolstof is dat het de zogenaamde "bouwsteen van het leven" vormt en aanwezig is in alle levende organismen.
index
- 1 Waar wordt koolstof gevonden en in welke vorm?
- 1.1 Kristalvormen
- 1.2 Amorfe vormen
- 1.3 Olie, aardgas en bitumen
- 2 Fysische en chemische eigenschappen
- 2.1 Chemisch symbool
- 2.2 Atoomnummer
- 2.3 Fysieke toestand
- 2.4 Kleur
- 2.5 Atomaire massa
- 2.6 Smeltpunt
- 2.7 Kookpunt
- 2.8 Dichtheid
- 2.9 Oplosbaarheid
- 2.10 Elektronische configuratie
- 2.11 Aantal elektronen in de buitenste of valentie laag
- 2.12 Koppelingscapaciteit
- 2.13 Catenación
- 3 Biogeochemische cyclus
- 3.1 Fotosynthese
- 3.2 Ademen en ontbinden
- 3.3 Geologische processen
- 3.4 Interferentie van menselijke activiteit
- 4 Gebruik
- 4.1 Olie en aardgas
- 4.2 Grafiet
- 4.3 Diamant
- 4.4 Antraciet
- 4.5 Steenkool
- 4.6 Bruinkool
- 4.7 Turf
- 5 Referenties
Waar wordt koolstof gevonden en in welke vorm?
Naast het feit dat het de chemische component is die alle vormen van leven gemeenschappelijk hebben, is koolstof in de natuur aanwezig in drie kristallijne vormen: diamant, grafiet en fullereen.
Er zijn ook verschillende amorfe minerale vormen van steenkool (antraciet, bruinkool, steenkool, turf), vloeibare vormen (variëteiten van oliën) en soda (aardgas).
Kristalvormen
In de kristallijne vormen voegen de koolstofatomen zich samen en vormen geordende patronen met geometrische ruimtelijke rangschikking.
grafiet
Het is een zachte vaste stof van zwarte kleur met glans of metaalachtige glans en bestand tegen hitte (ongevoelig). Zijn kristallijne structuur presenteert koolstofatomen die zijn verbonden in hexagonale ringen die op hun beurt de vorm vormen van vellen.
Grafietafzettingen zijn schaars en zijn gevonden in China, India, Brazilië, Noord-Korea en Canada.
diamant
Het is een zeer harde vaste stof, transparant voor de doorgang van licht en veel dichter dan grafiet: de waarde van de dichtheid van de diamant komt overeen met bijna tweemaal die van grafiet.
De koolstofatomen in de diamant verbinden zich in tetraëdrische meetkunde. Evenzo wordt de diamant gevormd uit grafiet, onderworpen aan omstandigheden van zeer hoge temperaturen en drukken (3000 °C en 100 000 atm).
De meeste diamanten bevinden zich tussen 140 en 190 km diep in de mantel. Door diepe vulkaanuitbarstingen kan magma ze naar afstanden dicht bij het oppervlak vervoeren.
Er zijn diamant deposito's in Afrika (Namibië, Ghana, Democratische Republiek Congo, Sierra Leone en Zuid-Afrika), Amerika (Brazilië, Colombia, Venezuela, Guyana, Peru), Oceanië (Australië) en Azië (India).

fullerenen
Het zijn moleculaire koolstofvormen die clusters van 60 en 70 koolstofatomen vormen in bijna bolvormige moleculen, vergelijkbaar met voetballen.
Er zijn ook fullerenen kleiner dan 20 koolstofatomen. Sommige vormen van fullerenen omvatten koolstofnanobuisjes en koolstofvezels.

Amorfe vormen
In amorfe vormen verenigen de koolstofatomen zich niet en vormen een ordelijke en regelmatige kristallijne structuur. In plaats daarvan bevatten ze zelfs onzuiverheden van andere elementen.
antraciet
Het is de oudste metamorfe minerale steenkool (die afkomstig is van de wijziging van gesteenten door effecten van temperatuur, druk of chemische werking van vloeistoffen), aangezien de formatie dateert uit het primaire of Paleozoïsche tijdperk, de Carboon periode.
Antraciet is de amorfe vorm van koolstof met een hoger gehalte aan dit element: tussen 86 en 95%. Het is grijszwart en metallic glanzend, en het is zwaar en compact.
Over het algemeen wordt antraciet aangetroffen in gebieden met geologische vervorming en vormt het ongeveer 1% van de steenkoolreserves in de wereld.
Geografisch wordt het gevonden in Canada, de VS, Zuid-Afrika, Frankrijk, Groot-Brittannië, Duitsland, Rusland, China, Australië en Colombia.

Steenkool
Het is een minerale steenkool, sedimentair gesteente van organische oorsprong, waarvan de formatie dateert uit de paleozoïsche en mesozoïsche tijdperken. Het heeft een koolstofgehalte tussen 75 en 85%.
Het is zwart, het wordt gekenmerkt doordat het ondoorzichtig is en een mat en vettig uiterlijk heeft, omdat het een hoog gehalte aan bitumineuze stoffen heeft. Het wordt gevormd door compressie van bruinkool in het Paleozoïcum, in de Carboon- en Permperiodes.
Het is de meest voorkomende vorm van steenkool op deze planeet. Er zijn grote kolenvoorraden in de Verenigde Staten, Groot-Brittannië, Duitsland, Rusland en China.
bruinkool
Het is een fossiele minerale steenkool gevormd in het tertiaire tijdperk van turf door compressie (hoge drukken). Het heeft een lager koolstofgehalte dan steenkool, tussen 70 en 80%.
Het is een klein compact materiaal, kruimelig (kenmerk dat het onderscheidt van andere koolstofmineralen), bruin of zwart. De textuur is vergelijkbaar met die van hout en het koolstofgehalte varieert van 60 tot 75%.
Het is een eenvoudige ontstekingsbrandstof met een lage calorische waarde en een lager watergehalte dan turf.
Er zijn belangrijke bruinkoolmijnen in Duitsland, Rusland, Tsjechië, Italië (regio Veneto, Toscane, Umbrië) en Sardinië. In Spanje zijn de bruinkoolafzettingen in Asturië, Andorra, Zaragoza en La Coruña.
veen
Het is een materiaal van organische oorsprong waarvan de formatie uit het Quartair tijdperk komt, veel recenter dan de vorige kolen.
Het is een bruingele kleur en verschijnt als een sponsachtige massa met lage dichtheid, waarin je plantenresten kunt zien van de plaats waar het vandaan kwam.
In tegenstelling tot de hiervoor genoemde kolen, turf wordt niet door vercooksing processen van houtmateriaal of hout, maar vooral gevormd door accumulatie van planten en kruiden moerassen musgos- door een carbonisatie proces niet aangevuld.
Turf heeft een hoog watergehalte; daarom is het voor gebruik droog en verdicht.
Het heeft een laag koolstofgehalte (slechts 55%); daarom heeft het een lage energiewaarde. Bij verbranding is het asresidu overvloedig en geeft het veel rook af.
Er zijn belangrijke veenafzettingen in Chili, Argentinië (Tierra del Fuego), Spanje (Espinosa de Cerrato, Palencia), Duitsland, Denemarken, Nederland, Rusland, Frankrijk.

Olie, aardgas en bitumen
Olie (uit het Latijn Petrae, wat "steen" betekent; en oleum, wat "olie" betekent: "steenolie") is een mengsel van vele organische verbindingen - de meeste koolwaterstoffen - geproduceerd door de anaerobe bacteriële afbraak (in afwezigheid van zuurstof) van organisch materiaal.
Het vormde zich in de ondergrond, op grote dieptes en onder speciale omstandigheden, zowel fysiek (hoge drukken en temperaturen) als chemisch (aanwezigheid van specifieke katalysatorverbindingen) in een proces dat miljoenen jaren duurde.
Tijdens dit proces werden de C en de H vrijgemaakt uit de organische weefsels en opnieuw samengevoegd om een enorm aantal koolwaterstoffen te vormen die werden gemengd op basis van hun eigenschappen, waarbij aardgas, olie en bitumen werden gevormd.
De olievelden van de planeet bevinden zich voornamelijk in Venezuela, Saoedi-Arabië, Irak, Iran, Koeweit, de Verenigde Arabische Emiraten, Rusland, Libië, Nigeria en Canada.
Er zijn aardgasreserves in onder meer Rusland, Iran, Venezuela, Qatar, de Verenigde Staten, Saoedi-Arabië en de Verenigde Arabische Emiraten.
Fysische en chemische eigenschappen
Onder de koolstofeigenschappen kunnen we het volgende noemen:
Chemisch symbool
C.
Atoom nummer
6.
Fysieke toestand
Vast, onder normale druk- en temperatuuromstandigheden (1 atmosfeer en 25 °C).
kleur
Grijs (grafiet) en transparant (diamant).
Atoom massa
12.011 g / mol.
Smeltpunt
500 °C.
Kookpunt
827 °C.
dichtheid
2,62 g / cm3.
oplosbaarheid
Onoplosbaar in water, oplosbaar in tetrachloorkoolstof CCl4.
Elektronische configuratie
1s2 2s2 2p2.
Aantal elektronen in de buitenlaag of valentie
4.
Koppel capaciteit
4.
catenation
Het heeft het vermogen om chemische verbindingen te vormen in lange ketens.
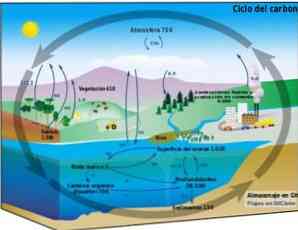
Biogeochemische cyclus
De koolstofcyclus is een circulair biogeochemisch proces waarbij koolstof kan worden uitgewisseld tussen de biosfeer, de atmosfeer, de hydrosfeer en de aardse lithosfeer.
De kennis van dit cyclische koolstofproces op de aarde maakt het mogelijk om menselijk handelen in deze cyclus en de gevolgen daarvan voor de wereldwijde klimaatverandering aan te tonen.
Koolstof kan circuleren tussen oceanen en andere watermassa's, alsook tussen de lithosfeer, in de bodem en ondergrond, in de atmosfeer en in de biosfeer. In de atmosfeer en de hydrosfeer bestaat koolstof als gas in gasvorm2 (koolstofdioxide).
fotosynthese
De koolstof in de atmosfeer wordt gevangen door de terrestrische en aquatische organismen van de ecosystemen (fotosynthetische organismen).
Fotosynthese maakt een chemische reactie tussen CO mogelijk2 en water, gemedieerd door zonne-energie en chlorofyl uit planten, om koolhydraten of suikers te produceren. Dit proces transformeert eenvoudige moleculen met een laag CO-energiegehalte2, H2O en zuurstof O2, in complexe moleculaire vormen van hoge energie, die suikers zijn.
De heterotrofe organismen - die de fotosynthese niet kunnen uitvoeren en die de consumenten in de ecosystemen zijn - verkrijgen koolstof en energie wanneer zij zichzelf voeden van de producenten en van andere consumenten.
Ademhaling en ontbinding
Ademen en ontbinden zijn biologische processen die koolstof afgeven aan het milieu in de vorm van CO2 of CH4 (methaan geproduceerd in de anaërobe afbraak, dat wil zeggen in afwezigheid van zuurstof).
Geologische processen
Door geologische en als gevolg van processen in de tijd, kan de anaërobe ontleding van koolstof worden omgezet in fossiele brandstoffen zoals aardolie, kolen en aardgas. Op dezelfde manier is koolstof ook onderdeel van andere mineralen en gesteenten.
Interferentie van menselijke activiteit
Wanneer de mens het verbranden van fossiele brandstoffen gebruikt voor energie, keert de koolstof terug naar de atmosfeer in de vorm van enorme hoeveelheden CO2 dat kan niet worden geassimileerd door de natuurlijke biogeochemische cyclus van koolstof.
Deze overmaat CO2 geproduceerd door menselijke activiteit heeft een negatief effect op de balans van de koolstofcyclus en is de belangrijkste oorzaak van het broeikaseffect.
toepassingen
Het gebruik van koolstof en zijn verbindingen is zeer gevarieerd. De meest opvallende met het volgende:
Olie en aardgas
Het belangrijkste economische gebruik van koolstof wordt weergegeven in het gebruik ervan als een koolwaterstof op fossiele brandstof, zoals methaangas en aardolie..
De olie wordt gedestilleerd in raffinaderijen meerdere derivaten zoals benzine, diesel, kerosine, asfalt, smeermiddelen, oplosmiddelen en andere, die op hun beurt worden gebruikt in de petrochemische industrie die grondstoffen voor de kunststoffen, meststoffen, farmaceutica en verven te verkrijgen , onder anderen.
grafiet
Grafiet wordt gebruikt in de volgende acties:
- Het wordt gebruikt bij de vervaardiging van potloden, gemengd met kleien.
- Het maakt deel uit van de vervaardiging van vuurvaste bakstenen en smeltkroezen, hittebestendig.
- In verschillende mechanische apparaten zoals ringen, lagers, zuigers en pakkingen.
- Het is een uitstekend vast smeermiddel.
- Vanwege de elektrische geleidbaarheid en de chemische inertie, wordt het gebruikt bij de fabricage van elektroden, elektromotorische kolen.
- Het wordt gebruikt als een moderator in kerncentrales.
diamant
Diamant heeft bijzonder uitzonderlijke fysische eigenschappen, zoals de hogere graad van hardheid en thermische geleidbaarheid die tot nu toe bekend is.
Deze functies maken industriële toepassingen mogelijk in gereedschappen voor het maken van snij- en polijstinstrumenten voor hun hoge schuurvermogen.
Optische eigenschappen zoals transparantie en de mogelijkheid om wit licht te breken en breken licht- kennen vele toepassingen in optische instrumenten en vervaardiging van lenzen en prisma.
De karakteristieke helderheid afgeleid van zijn optische eigenschappen wordt ook zeer gewaardeerd in de sieradenindustrie.
antraciet
Antraciet heeft moeite met ontsteken, is langzaam in brand en vereist veel zuurstof. De verbranding produceert een kleine vlam van lichtblauwe kleur en emissie van veel warmte.
Enkele jaren geleden werd antraciet gebruikt in thermo-elektrische installaties en voor huishoudelijke verwarming. Het gebruik ervan heeft voordelen zoals de productie van weinig as of stof, weinig rook en een langzaam verbrandingsproces.
Vanwege de hoge economische kosten en schaarste, is antraciet vervangen door aardgas in thermo-elektrische centrales en door elektriciteit in huizen.
Steenkool
Steenkool wordt gebruikt als grondstof om te verkrijgen:
- Cokes, brandstof van hoogovens in staalfabrieken.
- Creosoot, verkregen door het mengen van teer destillaat uit steenkool en gebruikt als een beschermende kit voor hout blootgesteld aan het weer.
- Cresol (chemisch methylfenol) geëxtraheerd uit steenkool en gebruikt als ontsmettingsmiddel en antisepticum,
- Andere derivaten zoals gas, teer of pek, en verbindingen gebruikt bij de bereiding van parfums, insecticiden, kunststoffen, bekledingen, banden en wegdek, etc..
bruinkool
Bruinkool vertegenwoordigt een brandstof van gemiddelde kwaliteit. De straal, de verscheidenheid van bruinkool, wordt gekenmerkt door zijn zeer compact door het lange proces van verkoling en hoge druk, en wordt gebruikt in sieraden en versieringen.
veen
Turf wordt gebruikt bij de volgende activiteiten;
- Voor de groei, ondersteuning en transport van plantensoorten.
- Als organische meststof.
- Als een bed van dieren in stallen.
- Als een brandstof van lage kwaliteit.
referenties
- Burrows, A., Holman, J., Parsons, A., Pilling, G. en Price, G. (2017). Chemie3: Introductie van anorganische, organische en fysische chemie. Oxford University Press.
- Deming, A. (2010). Koning van de elementen? Nanotechnologie. 21 (30): 300201.doi: 10.1088
- Dienwiebel, M., Verhoeven, G., Pradeep, N., Frenken, J., Heimberg, J. en Zandbergen, H. (2004). Superlubricity van Graphite. Physical Review Letters. 92 (12): 126101.doi: 10.1103
- Irifune, T., Kurio, A., Sakamoto, S., Inoue, T. en Sumiya, H. (2003). Materialen: Ultraharde polykristallijne diamant van grafiet. Nature. 421 (6923): 599 - 600. doi: 10.1038
- Savvatimskiy, A. (2005). Metingen van het smeltpunt van grafiet en de eigenschappen van vloeibare koolstof (een overzicht voor 1963-2003). Carbon. 43 (6): 1115. doi: 10.1016


