Afweging van methoden en voorbeelden van chemische vergelijkingen
de balancering van chemische vergelijkingen impliceert dat alle elementen aanwezig in de vergelijking hetzelfde aantal atomen aan elke zijde hebben. Om dit te bereiken is het noodzakelijk om de balanceermethoden te gebruiken om de stoichiometrische coëfficiënten toe te wijzen die geschikt zijn voor elke soort die aanwezig is in de reactie.
Een chemische vergelijking is de weergave, door middel van symbolen, van wat er gebeurt in de loop van een chemische reactie tussen twee of meer stoffen. De reactanten reageren met elkaar en afhankelijk van de reactieomstandigheden zullen een of meer verschillende verbindingen als een product worden verkregen..
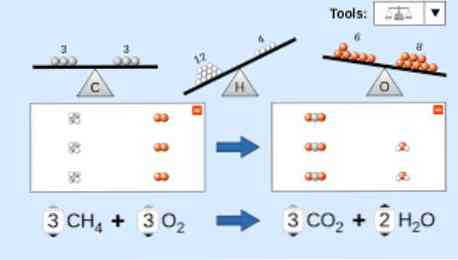
Bij het beschrijven van een chemische vergelijking moet het volgende in aanmerking worden genomen: Eerst worden de reagensstoffen aan de linkerkant van de vergelijking geschreven, gevolgd door een pijl in één richting of twee tegenovergestelde horizontale pijlen, afhankelijk van het type reactie dat wordt uitgevoerd. kaap.
index
- 1 Methoden voor het in evenwicht brengen van chemische vergelijkingen
- 1.1 Saldo chemische vergelijkingen met vallen en opstaan (ook wel aangeduid als inspectie of proef)
- 1.2 Algebraïsche balancering van chemische vergelijkingen
- 1.3 Rolling van redoxvergelijkingen (ion-elektron methode)
- 2 Voorbeelden van balancerende chemische vergelijkingen
- 2.1 Eerste voorbeeld
- 2.2 Tweede voorbeeld
- 2.3 Derde voorbeeld
- 3 referenties
In evenwicht brengende methodes van chemische vergelijkingen
Op basis van het feit dat de reactanten en producten bekend zijn en dat hun formules correct zijn weergegeven aan de zijde die overeenkomt met hen, gaan we verder met het in evenwicht brengen van de vergelijkingen volgens de volgende methoden.
Afweging van chemische vergelijkingen met vallen en opstaan (ook wel aangeduid als inspectie of proef)
Het is gebaseerd op de stoichiometrie van de reactie en probeert te proberen met verschillende coëfficiënten om de vergelijking in evenwicht te brengen, zolang de kleinst mogelijke gehele getallen worden gekozen waarmee aan beide zijden hetzelfde aantal atomen van elk element wordt verkregen van de reactie.
De coëfficiënt van een reactant of product is het getal dat voorafgaat aan zijn formule, en het is het enige getal dat kan worden gewijzigd bij het in evenwicht brengen van een vergelijking, aangezien het wijzigen van de subscripts van de formules de identiteit van de samenstelling zou veranderen in kwestie.
Tel en vergelijk
Nadat we elk element van de reactie hebben geïdentificeerd en het op de juiste kant hebben geplaatst, gaan we verder met het tellen en vergelijken van het aantal atomen van elk element dat in de vergelijking aanwezig is en bepalen we de atomen die in balans moeten zijn.
Vervolgens gaan we verder met het in evenwicht brengen van elk element (één per keer), door hele coëfficiënten te plaatsen voorafgaand aan elke formule die ongebalanceerde elementen bevat. Meestal worden eerst de metalen elementen in evenwicht gebracht, vervolgens de niet-metalen elementen en ten slotte de zuurstof- en waterstofatomen.
Op deze manier vermenigvuldigt elke coëfficiënt alle atomen van de voorgaande formule; dus terwijl je een element in balans houdt, kunnen de anderen uit balans raken, maar dit wordt gecorrigeerd als de reactie in balans is.
Tenslotte wordt het door een laatste telling bevestigd dat de hele vergelijking correct in evenwicht is, dat wil zeggen, dat het de wet van behoud van materie gehoorzaamt.
Algebraïsche balancering van chemische vergelijkingen
Om deze methode te gebruiken, wordt een procedure ingesteld om de coëfficiënten van de chemische vergelijkingen te behandelen als onbekenden van het systeem die moeten worden opgelost..
Eerst wordt een specifiek element van de reactie als referentie genomen en de coëfficiënten worden geplaatst als letters (a, b, c, d ...), die de onbekenden vertegenwoordigen, volgens de bestaande atomen van dat element in elk molecuul (als een soort bevat niet dat element is geplaatst "0").
Na het verkrijgen van deze eerste vergelijking, worden de vergelijkingen voor de andere elementen die aanwezig zijn in de reactie bepaald; er zullen zoveel vergelijkingen zijn als er elementen zijn in de reactie.
Ten slotte worden de onbekenden bepaald door een van de algebraïsche methoden voor reductie, egalisatie of substitutie en worden de coëfficiënten verkregen die resulteren in de correct gebalanceerde vergelijking.
Evenwichtige redoxvergelijkingen (ion-elektronenmethode)
Eerst wordt de algemene (onevenwichtige) reactie in zijn ionische vorm geplaatst. Dan is deze vergelijking verdeeld in twee halve reacties, de oxidatie en de reductie, elk balancerend volgens het aantal atomen, hun type en de ladingen van deze.
Voor de reacties die optreden in zuur medium worden bijvoorbeeld H-moleculen toegevoegd.2Of om de zuurstofatomen in evenwicht te brengen en H toe te voegen+ om de waterstofatomen te balanceren.
Daarentegen wordt in een alkalisch medium een gelijk aantal OH-ionen toegevoegd- aan de twee zijden van de vergelijking voor elke H ion+, en waar H-ionen ontstaan+ en OH- ze komen samen om H-moleculen te vormen2O.
Voeg elektronen toe
Dan moet je zoveel elektronen toevoegen als nodig is om de ladingen in balans te brengen, na het balanceren van de materie bij elke halve reactie.
Volgend op het rollen van elke halve reactie, worden deze toegevoegd en culmineerd door de laatste vergelijking met vallen en opstaan te balanceren. In het geval dat er een verschil is in het aantal elektronen van de twee halve reacties, moet een of beide worden vermenigvuldigd met een coëfficiënt die gelijk is aan dit aantal.
Ten slotte moet worden bevestigd dat de vergelijking hetzelfde aantal atomen en hetzelfde type atomen bevat, naast dezelfde ladingen aan beide zijden van de globale vergelijking.
Voorbeelden van chemische vergelij kingsvergelijkingen
Eerste voorbeeld
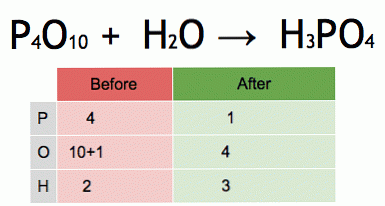
Dit is een animatie van een gebalanceerde chemische vergelijking. Fosforpentoxide en water worden omgezet in fosforzuur.
P4O10 + 6 H2O → 4 H3PO4 (-177 kJ).
Tweede voorbeeld
Je hebt de verbrandingsreactie van ethaan (onevenwichtig).
C2H6 + O2 → CO2 + H2O
Met behulp van de methode van vallen en opstaan om het te balanceren, wordt opgemerkt dat geen van de elementen hetzelfde aantal atomen heeft aan beide zijden van de vergelijking. Het begint dus met de koolstofbalans, waarbij een twee wordt toegevoegd als een stoichiometrische coëfficiënt die aan de zijkant van de producten wordt toegevoegd.
C2H6 + O2 → 2CO2 + H2O
Koolstof is aan beide kanten gebalanceerd, dus we gaan door met het in balans brengen van de waterstof door een drie toe te voegen aan het watermolecuul.
C2H6 + O2 → 2CO2 + 3H2O
Ten slotte, aangezien er zeven zuurstofatomen aan de rechterkant van de vergelijking zijn en dit het laatste element is dat nog moet worden gebalanceerd, wordt het fractionele getal 7/2 vóór het zuurstofmolecuul geplaatst (hoewel algemene coëfficiënten over het algemeen de voorkeur hebben).
C2H6 + 7 / 2O2 → 2CO2 + 3H2O
Verifieer vervolgens dat aan elke kant van de vergelijking hetzelfde aantal koolstofatomen (2), waterstof (6) en zuurstof (7) aanwezig is.
Derde voorbeeld
De oxidatie van ijzer door dichromate-ionen komt voor in een zuur medium (ongebalanceerd en in zijn ionische vorm).
geloof2+ + Cr2O72- → Geloof3+ + Cr3+
Met behulp van de ion-elektronenmethode voor het uitbalanceren, is het verdeeld in twee halve reacties.
Oxidatie: geloof2+ → Geloof3+
Reductie: Cr2O72- → Cr3+
Omdat de ijzeratomen al in balans zijn (1: 1), wordt aan de zijkant van de producten een elektron toegevoegd om de lading in evenwicht te brengen.
geloof2+ → Geloof3+ + en-
Nu zijn de atomen van Cr gebalanceerd en voegen een twee toe aan de rechterkant van de vergelijking. Vervolgens, wanneer de reactie plaatsvindt in zuur milieu, worden zeven H-moleculen toegevoegd.2Of aan de zijkant van de producten om de zuurstofatomen in evenwicht te brengen.
Cr2O72- → 2Cr3+ + 7H2O
Om de H-atomen in balans te brengen, worden veertien H-ionen toegevoegd+ aan de kant van de reactanten en, na het egaliseren van het materiaal, worden de ladingen in evenwicht gebracht door de toevoeging van zes elektronen aan dezelfde kant.
Cr2O72- +14H+ + 6e- → 2Cr3+ + 7H2O
Tenslotte worden beide halve reacties toegevoegd, maar omdat er slechts één elektron in de oxidatiereactie zit, moet dit allemaal vermenigvuldigd worden met zes.
6Fe2+ + Cr2O72- +14H+ + 6e- → Geloof3+ + 2Ch3+ + 7H2O + 6e-
Ten slotte moeten de elektronen aan beide kanten van de globale ionische vergelijking worden geëlimineerd, waarbij wordt geverifieerd dat hun lading en materie correct in evenwicht zijn.
referenties
- Chang, R. (2007). Chemie. (Negende ed). McGraw-Hill.
- Hein, M. en Arena, S. (2010). Foundations of College Chemistry, Alternate. Opgehaald uit books.google.co.ve
- Tuli, G.D. en Soni, P.L. (2016). De taal van de chemie of chemische vergelijkingen. Opgehaald uit books.google.co.ve
- Speedy Publishing (2015). Chemie vergelijkingen en antwoorden (snelle studiegidsen). Opgehaald uit books.google.co.ve


