Hypochlorous Acid (HClO) -formule, eigenschappen en toepassingen
de hypochloorzuur, ook bekend als monoxocloorzuur (I), is een chemische verbinding met de formule HClO. Het is een eenvoudig molecuul met de centrale zuurstof verbonden met de chloor- en waterstofatomen door eenvoudige bindingen.
Het is een chlooroxzuur, dat valentie (I) heeft. Het is een zwak zuur dat meestal wordt gevormd wanneer chloor in water oplost. Verwezen wordt naar verschillende andere namen, zoals: chloorzuur, chlooranalcohol, waterstofhypochloriet en chloorhydroxide.
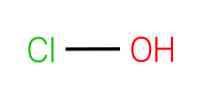
Hypochloorzuur wordt geproduceerd in het menselijk lichaam door witte bloedcellen om infecties te bestrijden, omdat het werkt tegen een breed scala van micro-organismen.
De toevoeging van chloor aan water geeft hypochloorzuur samen met zoutzuur (HCl):
Cl2 + H2O ⇌ HOCl + HCl
De bovenstaande reactie is in evenwicht en het is niet gemakkelijk om HOCl uit dit mengsel te isoleren. Stabiele hypochlorige zouten kunnen echter worden verkregen door chloorgas op te lossen in natriumhydroxide-oplossing of andere waterige basische oplossingen.
HOCl kan ook worden bereid door dichloormonoxide in water op te lossen (gebruik als hypochloriumzuur, eigenschappen, structuur en formule, S.F.).
Cl2O + H2O → 2HOCl
index
- 1 Fysische en chemische eigenschappen
- 2 Antimicrobiële werking
- 3 Gebruik
- 3.1 Chloorhydrinevorming
- 3.2 Cosmetische industrie
- 3.3 Waterbehandeling
- 3.4 Behandeling van pruritus
- 4 Referenties
Fysische en chemische eigenschappen
Het hypochloorzuur bestaat alleen als een waterige oplossing. Het is een kleurloze oplossing en de exacte fysische eigenschappen ervan zijn variabel, omdat ze afhankelijk zijn van de concentratie van de oplossing. Het watervrije of droge hypochloorzuur is onmogelijk te bereiden omdat het molecuul in evenwicht is met het anhydride ervan (Nationaal Centrum voor Biotechnologie-informatie., 2017).
Het molecuulgewicht ervan is 52,46 g / mol en zijn pKa is 7,53. Het is oplosbaar in water.
HOCl is een sterk oxidatiemiddel en kan ontplofbare mengsels vormen. Het is ook een reductiemiddel dat in staat is om te oxideren tot de chloor-, chlori- sche en perchloorzuur van het zuur. In waterige oplossingen, zijnde een zwak zuur, dissocieert het gedeeltelijk in het hypochlorietion (OCI-) en H+.
HOCl reageert met basen om zouten te vormen die hypochlorieten worden genoemd. Zo wordt natriumhypochloriet (NaOCl), het actieve ingrediënt in het bleekmiddel, gevormd door hypochloorzuur te laten reageren met natriumhydroxide (Royal Society of Chemistry, 2015).
HOCl + NaOH → NaOCl + H2O
Hypochloorzuur reageert ook gemakkelijk met een verscheidenheid aan organische moleculen en biomoleculen.
Hypochloorzuur wordt niet als schadelijk beschouwd, omdat het in lage concentraties in het menselijk lichaam voorkomt en antimicrobiële werking heeft.
Hypochlorigzuur reageert langzaam met DNA en RNA, evenals alle nucleotiden in vitro.
GMP is het meest reactief omdat HClO reageert met zowel de heterocyclische NH-groep als de aminogroep.
Evenzo is TMP met slechts één heterocyclische NH-groep die reactief is met HC10 de tweede meest reactieve.
AMP en CMP, die slechts één langzaam reagerende aminogroep hebben, zijn minder reactief met HClO.
Er is gerapporteerd dat UMP slechts in een erg langzaam tempo reactief is. De heterocyclische NH-groepen zijn reactiever dan de aminogroepen en hun secundaire chlooraminen kunnen het chloor afstaan.
Deze reacties waarschijnlijk verstoren baseparing van DNA, en in overeenstemming hiermee is gerapporteerd een afname van de viscositeit van DNA blootgesteld vergelijkbaar met dat met de hitte denaturatie (Prutz, 1996) HClO.
De suikerresten zijn niet-reactief en de DNA-backbone breekt niet. NADH kan reageren met gechloreerde TMP en UMP, evenals met HClO. Deze reactie kan UMP en TMP regenereren en resulteert in het 5-hydroxyderivaat van NADH.
De reactie met TMP of UMP is langzaam reversibel om HClO te regenereren. Een tweede, langzamere reactie die resulteert in splitsing van de pyridinering treedt op wanneer overmaat HC10 aanwezig is. NAD + is inert voor HClO.
Antimicrobiële actie
In de afgelopen 15 jaar zijn de meest geavanceerde hypochloorzuuroplossingen op basis van elektrochemie als veilige en levensvatbare wondreinigingsmiddelen en aanvullende therapieën voor de behandeling van infecties naar voren gekomen..
De oplossing hypochloorzuur (HOCl) is een sterk oxidatiemiddel en neigt om elektronen uit een andere stof te verwijderen. Het natriumzout, natriumhydroxide (NaClO), of het calciumzout, calciumhydroxide (Ca (ClO) 2) worden algemeen gebruikt bij het bleken, ontsmettingsmiddelen en deodorants.
HOCl bestaat als een natuurlijk endogeen bestanddeel bij mensen en dieren en is een belangrijk onderdeel van het aangeboren immuunsysteem. HOCl wordt geproduceerd door neutrofiele granulocyten, het meest voorkomende type witte bloedcellen bij zoogdieren. Is betrokken bij de laatste stap van de Oxidative Route in de strijd tegen infectie en de invasie van vreemde stoffen.
Wanneer een cel de invasie van een vreemde substantie detecteert, ondergaat deze fagocytose, waarbij de neutrofielen micro-organismen of vreemde deeltjes opnemen en internaliseren. Deze fagocytische gebeurtenis resulteert in de uitscheiding van reactieve zuurstofspecies en hydrolytische enzymen (Kavros, S.F.).
Zuurstofverbruik tijdens de opwekking van reactieve zuurstofspecies, "reactieve explosie" genaamd, omvat de activering van het enzym NADPH-oxidase, dat grote hoeveelheden superoxide produceert.
Deze zeer reactieve zuurstofspecies ontleedt in waterstofperoxide, dat vervolgens wordt omgezet in HOCl. HOCl oefent bacteriedodende eigenschappen uit en vernietigt onmiddellijk bacteriën die zijn ingeslikt door neutrofielen. Ondanks de aanzienlijke activiteit van HOCl tegen micro-organismen, is het niet cytotoxisch voor menselijke of dierlijke cellen. Dit heeft waarschijnlijk te maken met de endogene aanwezigheid in het immuunsysteem van zoogdiercellen (Chanson Water Ionizers USA, Inc, 2016).

Onlangs is voorgesteld om bacteriële inactivatie door HOCl is het resultaat van remming van DNA-replicatie. Wanneer bacteriën worden blootgesteld aan HOCl, er een plotselinge afname van DNA-synthese waarbij de remming van eiwitsynthese voorafgaat, en is zeer vergelijkbaar met het verlies van levensvatbaarheid (Davies, 1988).
Tijdens replicatie van het bacteriële genoom, de oorsprong van replicatie (oriC in E. coli) bindt aan eiwitten die zijn geassocieerd met het celmembraan, en vonden dat behandeling met HOCl vermindert de affiniteit voor membranen geëxtraheerd oriC, en deze affiniteit daalt parallel met het verlies van levensvatbaarheid.
In het werk van Henry Rosen (1998) vergeleken zij inhibitiesnelheid van HOCl van DNA-replicatie van plasmiden met verschillende oorsprongen van replicatie en gevonden dat bepaalde plasmiden toonden een vertraging in de remming van replicatie in vergelijking met plasmiden ze zijn met oriC. Rosen groep voorgesteld dat de inactivatie van membraaneiwitten die betrokken zijn bij DNA-replicatie is het werkingsmechanisme van HOCl.
toepassingen
Vorming van chloorhydrinen
Hypochloorzuur wordt gebruikt in organische synthese, waarbij alkenen worden omgezet in chloorhydrinen.
Het hypochloorzuur reageert met de onverzadigde bindingen in de lipiden, maar niet in de verzadigde bindingen en het ClO-ion neemt niet deel aan deze reactie.
Deze reactie wordt geproduceerd door hydrolyse met de toevoeging van chloor aan een van de koolstofatomen en een hydroxyl aan de andere. De resulterende verbinding is een chloorhydrine. Polair chloor verstoort lipide dubbellagen en kan de permeabiliteit vergroten.
Wanneer de vorming van chloorhydrine optreedt in de lipidedubbellagen van rode bloedcellen, neemt de permeabiliteit toe. De onderbreking kan optreden als voldoende chloorhydrine wordt gevormd.
De toevoeging van voorgevormde chloorhydrinen aan rode bloedcellen kan ook de doorlaatbaarheid beïnvloeden. Cholesterol-chloorhydrinen zijn ook waargenomen, maar hebben geen grote invloed op de doorlaatbaarheid, en er wordt aangenomen dat Cl2 verantwoordelijk is voor deze reactie
Cosmetische industrie
In de cosmetische industrie wordt het gebruikt als reinigingsmiddel voor de huid, wat de huid van het lichaam ten goede komt in plaats van uitdroging. Het wordt ook gebruikt in babyproducten, omdat de huid van de baby bijzonder gevoelig is en gemakkelijk geïrriteerd kan raken.
Waterbehandeling
Bij de behandeling van water is hypochloorzuur het actieve ontsmettingsmiddel in producten op basis van hypochloriet (bijvoorbeeld gebruikt in zwembaden).
In de foodservice en water-, gespecialiseerde zwakke oplossingen HClO uit water en zout apparatuur genereren wordt soms gebruikt om geschikte veilige desinfecterende genereren (instabiele) bedraagt de oppervlakken van voedingsbereiding en voorraden te behandelen water.
Pruritus behandeling
Onlangs is topicaal hypochloorzuur (HOCl) voorgesteld als een behandeling voor pruritus. Er worden twee mechanismen voorgesteld waarmee HOCl pruritus kan verminderen:
1) HOCl is vooral microbicide tegen huidpathogenen Staphylococcus aureus bij atopische dermatitis.
2) HOCl is ontstekingsremmend en vermindert de activiteiten van histamine, leukotriene B4 en interleukine-2, allemaal betrokken bij de pathofysiologie van jeuk.
Er zijn omstandigheden waaronder HOCl jeuk daadwerkelijk kan veroorzaken als een nadelig effect. HOCl verhoogt bijvoorbeeld de activiteit van de zenuwgroeifactor, die jeuk bevordert. Langdurige blootstelling of een hoge dosis HOCl kan ook irriterende contactdermatitis veroorzaken of, minder vaak, allergische contactdermatitis (Robert Y. Pelgrift, 2013).
referenties
- Chanson Water Ionizers USA, Inc. (2016). hypochloorzuur ontdekking. Teruggewonnen uit chansonalkalinewater: chansonalkalinewater.com.
- Davies, S. M. (1988). De remming van bacteriegroei door hypochloorzuur. Mogelijke rol in de bactericide activiteit van fagocyten. Biochem J. 254 (3), 685-692. ncbi.nlm.nih.gov.
- EMBL-EBI. (2014, 31 maart). hypochloorzuur. Teruggeplaatst van ebi.ac.uk: ebi.ac.uk.
- Henry Rosen, B.R. (1998). Differentiële effecten van door myeloperoxidase afgeleide oxidanten op DNA-replicatie van Escherichia coli. Infectie immuniteit. 66 (6), 2655-2659. ncbi.nlm.nih.gov.
- Gebruik van hypochlorig zuur, eigenschappen, structuur en formule. (S.F.). Herstelde desoftschools: softschools.com.
- Kavros, S. (S.F.). Het gebruik van hypochloride zure oplossing in wondbehandeling. Hersteld van faim.org.
- Nationaal centrum voor biotechnologische informatie ... (2017, 25 maart). PubChem Compound-database; CID = 24341. Opgehaald van PubChem.
- Prütz, W.A. (1996). Hypochloorzuur Interacties met thiolen, Nucleotiden, DNA en andere biologische substraten. Archives of Biochemistry and Biophysics Volume 332, Issue 1 ,, 110-120. Hersteld van sciencedirect.com.
- Robert Y. Pelgrift, A.J. (2013). Actueel hypochloorzuur (HOCl) als een potentiële behandeling van jeuk. Current Dermatology Reports, Volume 2, Number 3, 181. Geïntroduceerd bij springer.com.
- Royal Society of Chemistry. (2015). Hypochloorzuur. Opgehaald van chemspider: chemspider.com.


