Propaanzuurformule, eigenschappen, risico's en toepassingen
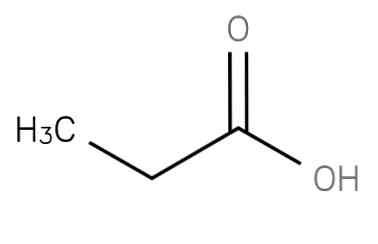
de propaanzuur is een verzadigd vetzuur met een korte keten dat ethaan omvat dat is bevestigd aan het koolstofatoom van een carboxygroep. De formule is CH3-CH2-COOH. Het anion CH3CH2COO- evenals de zouten en esters van propaanzuur zijn bekend als propionaten (of propanoaten).
Het kan worden verkregen uit afvalhoutpulp door middel van een fermentatieproces met behulp van bacteriën van het geslacht Propionibacterium. Het wordt ook verkregen uit ethanol en koolmonoxide met behulp van een boortrifluoride-katalysator (O'Neil, 2001).
Een andere manier om propaanzuur te verkrijgen is door de oxidatie van propionaldehyde in de aanwezigheid van kobalt- of mangaanionen. Deze reactie ontwikkelt zich snel bij temperaturen zo laag als 40-50 ° C:
2CH3CH2CHO + O2 → 2CH3CH2COOH
De verbinding is van nature aanwezig in kleine hoeveelheden in zuivelproducten en komt in het algemeen, en andere korte-keten vetzuren in het maagdarmkanaal van mensen en andere zoogdieren als eindproduct van microbiële vertering van koolhydraten.
Heeft een significante fysiologische activiteit bij dieren (Human Metabolome Database, 2017).
index
- 1 Fysische en chemische eigenschappen
- 2 Reactiviteit en gevaren
- 3 Biochemie
- 4 Gebruik
- 5 Referenties
Fysische en chemische eigenschappen
Propaanzuur is een kleurloze en olieachtige vloeistof met een scherpe, onaangename en ranzige geur. Het uiterlijk wordt weergegeven in Figuur 2 (Nationaal centrum voor biotechnologie-informatie, 2017).

Het propaanzuur heeft een molecuulgewicht van 74,08 g / mol en een dichtheid van 0,992 g / ml. Het vriespunt en het kookpunt zijn respectievelijk -20,5 ° C en 141,1 ° C. Propaanzuur is een zwak zuur met een pKa van 4,88.
De verbinding is zeer oplosbaar in water, in staat om 34,97 gram verbinding per 100 ml oplosmiddel op te lossen. Het is ook oplosbaar in ethanol, ether en chloroform (Royal Society of Chemistry, 2015).
Propaanzuur heeft tussenliggende fysische eigenschappen tussen die van kleinere carbonzuren, mierenzuur en azijnzuren en grotere vetzuren.
Het toont de algemene eigenschappen van carbonzuren en kan amide-, ester-, anhydride- en chloridederivaten vormen. Het kan alpha-halogenation met broom in de aanwezigheid van PBR3 als katalysator (de HVZ-reactie) ondergaan om CH3CHBrCOOH te vormen.
Reactiviteit en gevaren
Propaanzuur is een ontvlambaar en brandbaar materiaal. Het kan worden ontstoken door hitte, vonken of vlammen. Dampen kunnen explosieve mengsels vormen met lucht, in staat zijn om naar de ontstekingsbron te reizen en te ontploffen.
De meeste dampen zijn zwaarder dan lucht. Ze zullen zich over de grond verspreiden en worden verzameld in lage of besloten ruimtes (riolen, kelders, tanks). Gevaar voor explosie van stoom binnenshuis, buitenshuis of in riolen.
Stoffen aangeduid met een (P) kunnen explosief polymeriseren wanneer ze worden verwarmd of in een vuur worden gewikkeld. Containers kunnen exploderen bij verhitting (PROPIONIC ACID, 2016).
De verbinding moet uit de buurt van hitte of ontstekingsbronnen worden gehouden. Bij verhitting tot ontleding worden er scherpe rook en irriterende dampen afgegeven.
Propaanzuur is irriterend voor huid, ogen, neus en keel, maar produceert geen acute systemische effecten en heeft geen aantoonbaar genotoxisch potentieel. In geval van contact met water wassen (Material Safety Data Sheet Propionic acid, 2013).
biochemie
De geconjugeerde base van propionzuur, propionaat, wordt gevormd als het terminale fragment drie koolstofatomen (geactiveerd enzym A als propionyl-CoA) in de oxidatie van vetzuren oneven aantal koolstofatomen en oxidatie van de zijketen cholesterol.
Experimenten met radioactieve isotopen van propionaat die zijn geïnjecteerd bij nuchterratten geven aan dat het kan voorkomen in glycogeen, glucose, tussenproducten van de citroenzuurcyclus, aminozuren en eiwitten.
Om het metabolisme propionzuur omvat interactie met co-enzym A, carboxylering de methylmalonyl-coenzym A en omzetting barnsteenzuur, waarbij de citroenzuurcyclus binnenkomt vormen.
De propionzuur kan worden geoxideerd zonder vorming van ketonen en, in tegenstelling tot azijnzuur, wordt opgenomen in een koolhydraat en een lipide (Bingham, Cohrssen, en Powell, 2001).
Propionzuuracidurie is een van de meest voorkomende organische acidurieën, een ziekte die veel verschillende aandoeningen omvat.
Het resultaat van patiënten geboren met propionzuuracidurie is slecht in patronen van intellectuele ontwikkeling, 60% heeft een IQ van minder dan 75 en vereist speciaal onderwijs.
Succesvolle lever- en / of niertransplantaties bij enkele patiënten hebben geresulteerd in een betere kwaliteit van leven, maar hebben niet noodzakelijk neurologische en viscerale complicaties voorkomen.
Deze resultaten benadrukken de noodzaak van permanente metabole monitoring, onafhankelijk van de therapeutische strategie.
toepassingen
Propaanzuur remt de groei van bacteriën en schimmels op niveaus tussen 0,1 en 1% per gewicht. Dientengevolge wordt het meeste van het geproduceerde propaanzuur geconsumeerd als een conserveermiddel voor zowel voedsel als voer voor menselijke consumptie, zoals granen en granen..
Het behoud van voer, granen en voedsel, evenals de productie van calcium en natriumpropionaat dat in 2016 bijna 80% van de wereldwijde consumptie van propaanzuur vertegenwoordigt, vergeleken met 78,5% in 2012.
Ongeveer 51% van de wereldwijd gebruikte hoeveelheid propionzuur is bestemd voor veevoer en conservering van graan, terwijl bijna 29% wordt gebruikt bij de productie van propionaten van calcium en natrium, die ook worden gebruikt in de voedingsindustrie en diervoeders.
Andere belangrijke markten voor propaanzuur zijn de productie van herbiciden en die van diethylketon. Toepassingen met een lager volume omvatten celluloseacetaatpropionaat, farmaceutische producten, oplosmiddelesters, smaakstoffen en geurstoffen, weekmakers, kleurstoffen en hulpstoffen voor textiel, leer en rubber.
De vraag naar propaanzuur hangt in grote mate af van de productie van voer en granen, gevolgd door verpakte levensmiddelen en bakkerijproducten.
De vooruitzichten voor de wereldwijde groei van propaanzuur en zijn zouten in diervoeder / graan en voedselconservering zijn aanzienlijk (IHS Markit, 2016).
Andere snelgroeiende markten omvatten propionaatesters voor oplosmiddelen, zoals n-butylpropionaat en pentyl; Deze esters worden in toenemende mate gebruikt als vervangers voor oplosmiddelen die worden vermeld als gevaarlijke luchtverontreinigende stoffen.
referenties
- Bingham, E., Cohrssen, B., & Powell, C. (2001). Patty's Toxicology Volumes 1-9 5e druk. New York: John Wiley & Sons.
- EMBL-EBI. (2016, 14 oktober). propionzuur. Hersteld van ChEBI: ebi.ac.uk.
- Menselijke Metabolome-database. (2017, 2 maart). Propionzuur. Opgehaald van hmdb.ca: hmdb.ca.
- IHS Markit. (2016, december). Handboek voor chemische economie Propionzuur. Teruggeplaatst van ihs: ihs.com.
- Veiligheidsinformatieblad Propionzuur. (2013, 21 mei). Teruggeplaatst van sciencelab: sciencelab.com.
- Nationaal centrum voor informatie over biotechnologie ... (2017, 22 april). PubChem Compound-database; CID = 1032. Teruggeplaatst van pubchem.ncbi.nlm.nih.gov.
- O'Neil, M. (. (2001), The Merck Index - An Encyclopedia of Chemicals, Drugs and Biologicals, 13th Edition, New Jersey: Merck and Co., Inc..
- PROPIONZUUR. (2016). Ontvangen van cameochemicals: cameochemicals.noaa.gov.
- Royal Society of Chemistry. (2015). Propionzuur. Opgehaald van chemspider: chemspider.com.


