Aluminiumchloride (AlCl3) chemische structuur, eigenschappen, toepassingen
de aluminiumchloride of aluminiumtrichloride (AlCl3) is een binair zout gevormd door aluminium en chloor. Soms verschijnt het als een geel poeder omdat het onzuiverheden veroorzaakt door de aanwezigheid van ijzer (III) chloride.
Het wordt verkregen door de elementen ervan te combineren. Aluminium, dat drie elektronen in zijn laatste energieniveau heeft (familie IIIA), heeft de neiging dit op te leveren vanwege zijn metaalachtige karakter. Chloor met zeven elektronen in het laatste energieniveau (VIIA-familie) heeft de neiging om ze te krijgen om zijn octet te voltooien.
Er wordt aangenomen dat de binding gevormd tussen aluminium en chloor in aluminiumtrichloride covalent is, hoewel het de vereniging is tussen een metaal en een niet-metaal.
Er zijn twee soorten aluminiumchloride:
- Watervrij aluminiumchloride. Aids3.
- Aluminiumchloride hexahydraat. Aids3. 6H2O. Deze verbinding kan worden gevonden in vaste of oplossingsvorm.
index
- 1 Chemische structuur
- 2 Eigenschappen
- 2.1 Fysiek
- 2.2 Chemisch
- 3 Gebruik
- 4 Risico's: mogelijke effecten
- 5 Aanbevelingen
- 6 Referenties
Chemische structuur
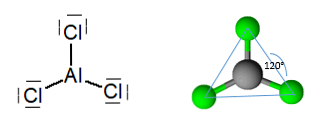
Watervrij aluminiumtrichloride, is een molecuul met een vlakke trigonale geometrie, met een hoek van 120 ° overeenkomend met een atomaire hybridisatie sp2.
Het molecuul is echter georganiseerd in de vorm van dimeren, waarbij een chlooratoom een paar elektronen doneert om obligaties te vormen. Deze staan bekend als gecoördineerde covalente obligaties.
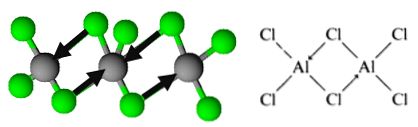
Dit is hoe de organisatie van aluminiumtrichloride dimeren wordt afgeleid.
Met deze organisatie kan de verbinding netwerken van dimere lagen vormen. Wanneer water wordt gegoten op het vaste aluminiumtrichloride dissociëren ze niet zoals verwacht van de ionische verbindingen, maar ondergaat ze krachtige hydrolyse.
Integendeel, in de verdunde waterige oplossing zijn de gecoördineerde ionen [Al (H2O)6]+3 en het chloride. Deze structuren lijken erg op die van diboraan.
Op deze manier heb je de formule Al2cl6
Als het verschil in de elektronegativiteit van de atomen waaruit de bindingen in deze verbinding bestaan, wordt gemeten, kan het volgende worden waargenomen:
Voor aluminium Al is de waarde van de elektronegativiteit 1,61 C en die van chloor 3,16 C. Het verschil in elektronegativiteit is 1,55 C.
Volgens de regels van de bindingstheorie moet een verbinding om ionisch te zijn een verschil hebben in de elektronegativiteit van de atomen waaruit de binding bestaat met een waarde groter dan of gelijk aan 1,7 C.
In het geval van de Al-Cl-binding is het verschil in elektronegativiteit 1,55 ° C, wat aluminiumtrichloride een covalente bindingsrangschikking geeft. Deze kleine waarde kan worden toegeschreven aan de gecoördineerde covalente bindingen van het molecuul.
eigenschappen
fysiek
verschijning: witte vaste stof, soms geel door onzuiverheden veroorzaakt door ferrichloride
dichtheid: 2,48 g / ml
Molaire massa: 133,34 g / mol
sublimering: sublimeert bij 178 ° C, dus het smelt- en kookpunt zijn erg laag.
aandrijving: slecht geleidt elektriciteit.
oplosbaarheid: het is niet oplosbaar in water omdat het een Lewis-zuur is. Het is oplosbaar in organische oplosmiddelen zoals benzeen, koolstoftetrachloride en chloroform.
chemisch
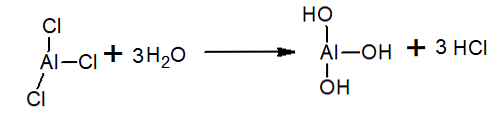
In het water wordt het aluminiumtrichloride gehydrolyseerd onder vorming van het HC1 en het hydroniumion en het aluminiumhydroxide:
Het wordt gebruikt in Friedel-Crafts-reacties als een katalysator (stof die aan het einde van de reactie kan worden teruggewonnen, omdat het alleen erin is om een reactie te versnellen, te vertragen of te starten).
Het is een bijtende stof.
Bij ontbinding wanneer het heftig met water reageert, produceert het aluminiumoxide en gevaarlijke gassen zoals waterstofchloride.
toepassingen
- anti-transpirant.
- Katalysator in acylatie en alkylering van Friedel-Crafts.
Risico's: mogelijke effecten
- Het is een bijtende stof, veroorzaakt brandwonden op de huid en ernstig oogletsel.
- Reageert heftig met water.
- Het is gevaarlijk voor het milieu.
- Zeer vergiftig voor in het water levende organismen.
aanbevelingen
Vermijd blootstelling aan het product zonder de noodzakelijke veiligheidsmaatregelen. Moet gebruiken, veiligheidsbril, handschoenen, goede kleding, afgedekte schoen.
In geval van inademing. Inademing van stof kan de luchtwegen irriteren vanwege de corrosieve aard van de stof. Symptomen zijn keelpijn, hoesten en kortademigheid. De symptomen van longoedeem kunnen te laat zijn en ernstige gevallen kunnen dodelijk zijn. Verplaats het slachtoffer naar een luchtige plaats zonder verontreinigingen. zorg indien nodig voor kunstmatige beademing. Als je moeite hebt met ademhalen, zorg dan voor zuurstof. Bel de dokter.
In geval van contact met de huid. De AlCl3 Het is bijtend. Het kan irritatie of brandwonden met roodheid en pijn veroorzaken. Was onmiddellijk na contact met veel water gedurende minimaal 20 minuten. Neutraliseer of voeg geen andere stoffen dan water toe. Verontreinigde kleding verwijderen en wassen voor hergebruik. raadpleeg onmiddellijk de arts in geval van letsel.
Bij contact met de ogen. De AlCl3 Het is bijtend. Het veroorzaakt intense pijn, wazig zien en weefselschade. Spoel de ogen onmiddellijk gedurende minimaal 20 minuten met water en houd de oogleden open om ervoor te zorgen dat het hele oog en de hele weefsels van het ooglid worden verwijderd. Het spoelen van de ogen in een kwestie van seconden is essentieel om maximale effectiviteit te bereiken. Als u contactlenzen heeft, verwijder deze dan na de eerste 5 minuten en spoel vervolgens verder met het spoelen van uw ogen. Raadpleeg de dokter. Het kan ernstige schade aan het hoornvlies, het bindvlies of andere delen van het oog veroorzaken.
In geval van inslikken. De AlCl3 Het is bijtend. Branden kan pijn in de mond en slokdarm en brandwonden van de slijmvliezen veroorzaken. Het kan gastro-intestinaal ongemak veroorzaken met buikpijn, misselijkheid, braken en diarree. BEGIN NIET BEGINNEN. Spoel de mond en geef water te drinken. Geef nooit iets oraal aan een bewusteloos persoon. Bel de dokter. Als er spontaan wordt overgegeven, plaats het slachtoffer dan op zijn of haar zij om het risico op aspiratie te verminderen.
Mensen met bestaande huidaandoeningen of oogproblemen of een verminderde ademhalingsfunctie kunnen vatbaarder zijn voor de effecten van de stof
De verpakking en opslag van de AlCl-verbinding3 moet worden gedaan op geventileerde, schone en droge plaatsen.
referenties
- Chemisch boek, (2017), aluminiumchloride. Hersteld van chemicalbook.com
- cosmos online, cosmos.com.mx
- Sharpe, A.G., (1993), Organic Chemistry, Spain, Editorial Reverté, S.A..
- F., (2017), AlCl-aluminiumchloride3, De Insignia. Genomen vanblog.elinsignia.com.
- TriHealth, (2018), Aluminium Trichloride, laatste update, 4 maart 2018, teruggevonden van trihealth.adam.com.
- RxWiki, (s.f), Aluminium Chloride, Retrieved from, rxwiki.com.


