Natriumdichromaat eigenschappen, productie, gevaren en toepassingen
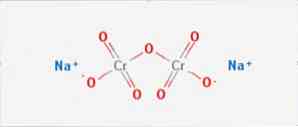
de natriumdichromaat is een anorganische verbinding met formule Na2Cr2O7. Het is een van de vele zeswaardige chroomverbindingen (Cr VI). De structuur is geïllustreerd in figuur 1, hoewel het zout meestal wordt behandeld in de gedihydrateerde vorm waarvan de formule Na2Cr2O7 · H2O is.
Het heeft twee ionische bindingen tussen de natriummoleculen en de negatief geladen zuurstofatomen. Het chroomerts wordt geëxtraheerd uit natriumdichromaat. Miljoenen kilogram natriumdichromaat worden jaarlijks geproduceerd.
China is de grootste producent van natriumdichromaat, maar Chinese chemische fabrieken hebben een relatief lage productie, minder dan 50.000 ton per jaar elk, in vergelijking met de fabriek in Kazachstan die meer dan 100.000 ton per jaar produceert.
Planten in Rusland, de Verenigde Staten en het Verenigd Koninkrijk hebben een intermediaire productie tussen 50.000 en 100.000 ton per jaar (Kogel, 2006).
Qua reactiviteit en uiterlijk heeft natriumdichromaat eigenschappen die vergelijkbaar zijn met kaliumdichromaat, maar het natriumzout is beter oplosbaar in water en heeft een gewicht dat minder is dan dat van het kaliumzout.
Natriumdichromaat produceert bij verhitting giftige chroomdampen. Het is een sterk oxidatiemiddel en is zeer corrosief.
Deze verbinding kan worden gevonden in drinkwaterbronnen verontreinigd met verschillende industriële processen zoals verzinken of galvaniseren, leerlooierij en textielproductie.
index
- 1 Fysische en chemische eigenschappen
- 2 Productiemethoden
- 3 Reactiviteit en gevaren
- 4 Toepassingen en toepassingen
- 5 Biochemie
- 6 Referenties
Fysische en chemische eigenschappen
Natriumdichromaat bestaat uit kristallen met een roodachtig oranje monokliene structuur in hun watervrije en geurloze vorm. Het molecuulgewicht is 261,97 g / mol in zijn watervrije vorm en 298,00 g / mol in de gedihydrateerde vorm ervan.
Het heeft een smeltpunt van 356,7 graden Celsius, een kookpunt van 400 graden Celsius waarin het uiteenvalt. Het heeft een dichtheid van 2,52 g / ml.

Figuur 2 toont het uiterlijk van natriumdichromaat. De oplosbaarheid in water is 187 gram per 100 gram bij 25 graden Celsius en zijn oplosbaarheid in ethanol is 513,2 gram per liter tot 19,4 graden Celsius (National Center for Biotechnology Information, S. F.).
Het wordt als een stabiele verbinding beschouwd als het wordt bewaard onder de aanbevolen omstandigheden en het is niet ontvlambaar. Omdat het een sterk oxidatiemiddel is, is het corrosief en in oplossing is het zuur met het vermogen om de pH te verlagen tot 4 in een oplossing van 1% w / v.
Productiemethoden
Natriumchromaat kan worden omgezet in dichromaat door een continu proces dat behandelt met zwavelzuur, kooldioxide of een combinatie van deze twee.
De verdamping van de natriumdichromaatvloeistof veroorzaakt de precipitatie van natriumsulfaat en / of natriumbicarbonaat en deze verbindingen worden verwijderd vóór de uiteindelijke kristallisatie van natriumdichromaat..
Natriumdichromaat kan in een driestapsproces worden gedaan:
- Alkalisch roosten van chromietoxidatieomstandigheden
- Uitspoeling. Extractie van oplosbare stoffen uit een mengsel door de inwerking van een vloeibaar oplosmiddel
- Omzetting van natriummonochromaat in natriumdichromaat door middel van een zuur.
Watervrij natriumdichromaat kunnen worden bereid door smelten natriumdichromaatdihydraat, kristallisatie waterige oplossingen van dichromaat boven 86 ° C of droogoplossingen natriumdichromaat in sproeidrogers.
Natriumdichromaatoplossingen op 69 en 70% w / v worden gebruikt als een handige en kosteneffectieve methode om hoeveelheden te verzenden, waarbij manuele hantering of oplossen van kristallen wordt vermeden.
Reactiviteit en gevaren
Het is een sterk oxidatiemiddel. Onverenigbaar met sterke zuren. Contact met brandbare materialen kan brand veroorzaken. Giftige dampen van chroomoxide kunnen worden gevormd in de aanwezigheid van warmte of vuur.
Het bekende "chroomzuurmengsel" van dichromaat en zwavelzuur met organische resten geeft aanleiding tot een heftige exotherme reactie. Dit mengsel in combinatie met acetonresiduen leidt ook tot een heftige reactie.
De combinatie van dichromaat en zwavelzuur met alcoholen, ethanol en 2-propanol, geeft aanleiding tot een heftige exotherme reactie. Vanwege het optreden van vele incidenten waarbij gemengd dichromaat-zwavelzuur wordt gemengd met oxideerbare organische materialen, is het waarschijnlijk het beste om dergelijke interacties te vermijden..
De combinatie van dichromaat met hydrazine is explosief, de dichromaatreactie kan naar verwachting krachtig zijn met amines in het algemeen. De toevoeging van het gedehydrateerde dichromaatzout aan azijnzuuranhydride leidt tot een uiteindelijk explosieve exotherme reactie.
Boor, silicium en dichromaten vormen pyrotechnische mengsels. Een mengsel van azijnzuur, 2-methyl-2-pentenal en dichromaat leidt tot een ongebreidelde reactie (Chemisch gegevensblad natriumdichromaat., 2016).
Inademing van stof of nevel veroorzaakt irritatie van de luchtwegen die soms op astma lijkt. Septumperforatie kan voorkomen. Het wordt beschouwd als vergif.
Inslikken veroorzaakt braken, diarree en, zeer ongebruikelijk, complicaties van de maag en de nieren. Contact met ogen of huid veroorzaakt plaatselijke irritatie. Herhaalde blootstelling aan de huid veroorzaakt dermatitis.
Natriumdichromaat is kankerverwekkend bij de mens. Er zijn aanwijzingen dat zeswaardige chroomverbindingen of Cr (VI) longkanker bij de mens kunnen veroorzaken. Het is aangetoond dat natriumdichromaat longkanker bij dieren veroorzaakt.
Terwijl natriumdichromaat niet is geïdentificeerd als teratogeen verbinding of reproductieve risico is bekend dat verbindingen van zeswaardig chroom Cr (VI) zijn teratogeen en reproductieve schade veroorzaken en vruchtbaarheid verminderen en interfereren met menstruele cycli.
Natriumdichromaat kan lever- en nierbeschadiging veroorzaken, dus het moet met uiterste zorg worden behandeld (New Jersey Department of Health, 2009).
In geval van inslikken moet het slachtoffer water of melk drinken; nooit braken opwekken. In geval van contact met de huid of ogen moet het worden behandeld als zure brandwonden; Spoel uw ogen gedurende minstens 15 minuten met water.
Uitwendige lesies kunnen worden gewreven met een 2% oplossing van natriumthiosulfaat. In alle gevallen moet een arts worden geraadpleegd.
Toepassingen en toepassingen
Afgezien van het belang ervan bij de vervaardiging van andere chroomchemicaliën, heeft natriumdichromaat ook veel directe toepassingen als ingrediënt bij de productie van:
- Metaalafwerking: helpt de corrosiebestendigheid en reinigt de metalen oppervlakken, bevordert ook de hechting van de verf.
- Biologische producten: gebruikt als oxidatiemiddelen bij de vervaardiging van producten zoals vitamine K en was.
- Pigmenten: gebruikt bij de vervaardiging van anorganische chromaatpigmenten waarbij een reeks kleuren stabiel is voor licht. Sommige graden van chromaat worden ook gebruikt als remmers van corrosie in de onderste lagen en primers.
- Keramiek: gebruikt bij de bereiding van gekleurde glazen en keramische glazuren.
- Textiel: gebruikt als bijtmiddel voor zure kleurstoffen om de snelkleurende eigenschappen te verbeteren.
- Productie van chroomsulfaat.
(Natriumdichromaat, de bouwsteen voor vrijwel alle andere chroomverbindingen., 2010-2012)
Natriumdichromaat Dihydraat, het gebruik ervan is ideaal in verschillende omstandigheden, waaronder toepassingen bij hoge temperaturen, zoals keramische glazuren en gekleurd glas.
Chromisch oxide, dat harder is dan andere metaaloxiden, zoals titanium of ijzer, is ideaal voor omgevingen waar de temperatuur en procesomstandigheden agressief zijn.
Deze stof wordt hoofdzakelijk gebruikt voor de productie van andere chroomverbindingen, maar wordt ook gebruikt in bentonietspoelen die worden gebruikt bij de productie van olie, in houtconserveringsmiddelen, bij de productie van organische chemicaliën en als corrosieremmer..
Wanneer gemengd met aluminium en kaliumdichromaat, met behulp van het alumino-thermische proces, produceert het chroomoxide hoogzuiver metaalachtig chroom. Dit is een essentieel ingrediënt in de productie van superlegeringen met hoge prestaties die worden gebruikt in de luchtvaartindustrie.
Bij organische synthese wordt natriumdichromaat gebruikt als een oxidatiemiddel in reductieoxidereacties in de aanwezigheid van zwavelzuur.
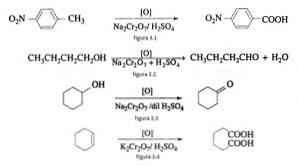
Bijvoorbeeld de oxidatie van p-nitrotolueen p-nitrobenzoëzuur vormen, bij de oxidatie van n-butanol n-butaldehido vormen bij de vorming van cyclohexanon uit cyclohexanol en de vorming van adipinezuur zoals weergegeven in figuren 3.1 , 3.2, 3.3 en 3.4 respectievelijk (VK Ahluwalia, 2004).
biochemie
Intratracheale indruppeling van natriumdichromaat (CrVI) en chroomacetaat hydroxide (CrIII) bij mannelijke ratten resulteerde in verhoogde concentraties chroom zijn volbloed, plasma en urine tot 72 uur na blootstelling; De maximale concentraties werden 6 uur na blootstelling bereikt.
De verhouding tussen volbloedchroom en plasmachroomconcentraties was significant verschillend voor de Cr (VI) - en Cr (III) -behandelingen. Daarom dienen analyses van chroom in bloed en chroom in plasma te worden gebruikt voor de evaluatie van blootstelling aan chroom.
Chroom werd ook gedetecteerd in perifere lymfocyten. Cr (VI), maar niet Cr (III) accumuleerde significant in lymfocyten na behandeling. Deze cellen kunnen als biomarkers worden gebruikt bij de beoordeling van blootstelling aan chroomverbindingen (Hooth, 2008).
referenties
- Chemisch gegevensblad Natriumdichromaat. (2016). Opgehaald uit cameo-chemicaliën: cameochemicals.noaa.
- Hooth, M. J. (2008). Technisch rapport over toxicologie en carcinogenese Studies van natriumdichromaat dihydraat. National Institute of Health USA.
- Kogel, J.E. (2006). Industrial Minerals & Rocks: Commodities, Markets and Uses zevende editie. littleton colorado: society of mining, metallurgyc and exploration inc.
- Nationaal centrum voor informatie over biotechnologie. (N.D.). PubChem Compound-database; CID = 25408. Teruggeplaatst van pubchem.com: pubchem.ncbi.nlm.nih.gov.
- New Jersey Department of Health. (2009, november). gevaarlijke stof fact sheet natriumdichromaat. Gevonden van nj.gov: nj.gov.
- Natriumdichromaat. De bouwsteen voor vrijwel alle andere chroomverbindingen. (2010-2012). Teruggeplaatst van elementis chromium: elementischromium.com
- K. Ahluwalia, R. A. (2004). Comprehensive Practical Organic Chemistry: Preparations And Quantitative Analysys. Delhi: Universitaire pers (India).


