Wet van Boyle-Mariotte geschiedenis, wiskundige uitdrukking, voorbeelden
De wet van Boyle is dat wat de relatie uitdrukt tussen de druk uitgeoefend door of op een gas, en het volume dat ermee wordt ingenomen; constant houden van de temperatuur van het gas, evenals de hoeveelheid (aantal mol).
Deze wet, samen met die van Charles, Gay-Lussac, Charles en Avogadro, beschrijft het gedrag van een ideaal gas; in het bijzonder in een gesloten houder die onderhevig is aan volumeveranderingen die worden uitgeoefend door een mechanische kracht.
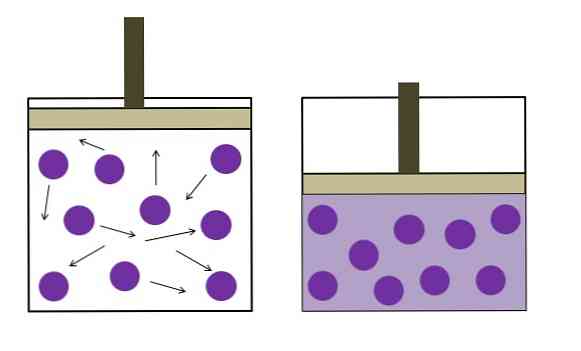
De afbeelding hierboven vat de wet van Boyle-Mariotte kort samen.
De paarse stippen stellen moleculen of gasatomen voor, die botsen met de binnenwanden van de container (links). Door de beschikbare ruimte of het volume van de container die door dit gas wordt ingenomen te verkleinen, nemen de botsingen toe, wat zich vertaalt in een toename van de druk (rechts).
Dit toont aan dat de druk P en het volume V van het gas omgekeerd evenredig zijn als de houder hermetisch is afgesloten; anders zou een hogere druk gelijk zijn aan een grotere uitzetting van de houder.
Als een grafiek V werd gemaakt tegen P, met de gegevens van respectievelijk V en P op de Y- en X-assen, zou een asymptotische curve worden waargenomen. Hoe kleiner V, hoe groter de toename in P; dat wil zeggen dat de curve zich uitstrekt tot hoge waarden van P op de X-as.
Natuurlijk blijft de temperatuur constant; maar als hetzelfde experiment bij verschillende temperaturen werd uitgevoerd, zouden de relatieve posities van deze krommen V vs P in de Cartesiaanse as veranderen. De verandering zou nog duidelijker zijn als deze op een driedimensionale as werd geplot, met constante T op de Z-as.
index
- 1 Geschiedenis van de wet van Boyle
- 1.1 Achtergrond
- 1.2 Experimenteer met kwik
- 1.3 Edme Mariotte
- 1.4 De wet versterken
- 2 Waaruit bestaat deze wet??
- 3 Wiskundige uitdrukking
- 4 Waar is het voor? Welke problemen loste de wet van Boyle op??
- 4.1 Stoommachines
- 4.2 Drink een drankje
- 4.3 Ademhalingssysteem
- 5 Voorbeelden (experimenten)
- 5.1 Experiment 1
- 5.2 Experiment 2
- 6 Referenties
Geschiedenis van de wet van Boyle
achtergrond
Omdat de wetenschapper Galileo Galilei zijn geloof in het bestaan van leegte (1638) uitdrukte, begonnen wetenschappers de eigenschappen van lucht en gedeeltelijke leegtes te bestuderen.
De Engels-Ierse chemicus, Robert Boyle, begon zijn studie van luchteigenschappen in 1638 toen hij hoorde dat Otto von Guericke, een Duitse ingenieur en fysicus, een luchtpomp had gebouwd.
Experimenteer met kwik
Voor het uitvoeren van zijn studies van luchtdruk, gebruikte Boyle een glazen buis in de vorm van "J", waarvan de constructie werd toegeschreven aan Robert Hooke, een assistent van Boyle. Het uiteinde van de korte arm was verzegeld, terwijl het uiteinde van de lange arm van de buis open was om het kwik te plaatsen.
Vanaf het begin wilde Boyle de elasticiteit van lucht, kwalitatief en kwantitatief bestuderen. Door kwik door het open uiteinde van de J-vormige buis te gieten, leidde Boyle af dat de lucht in de korte arm van de buis samentrok onder kwikdruk.
uitslagen
Hoe groter de hoeveelheid kwik die aan de buis wordt toegevoegd, hoe groter de druk die wordt uitgeoefend op de lucht en hoe lager het volume. Boyle heeft een grafiek van een negatief exponentieel type luchtvolume verkregen als een functie van druk.
Hoewel, als je het volume van de lucht tegen de inverse van de druk plot, heb je een rechte lijn met positieve helling.
In 1662 publiceerde Boyle de eerste fysische wet die werd gegeven in de vorm van een vergelijking, die de functionele afhankelijkheid van twee variabelen aangaf. In dit geval de druk en het volume.
Boyle wees erop dat er een omgekeerd verband was tussen de druk die op een gas werd uitgeoefend en het volume dat door dat gas werd ingenomen, waarbij deze verhouding relatief geldt voor echte gassen. De meeste gassen gedragen zich als ideale gassen bij matige druk en temperaturen.
Met hogere drukken en lagere temperaturen werden afwijkingen van het gedrag van de echte gassen van de idealen meer merkbaar.
Edme Mariotte
De Franse natuurkundige Edme Mariotte (1620-1684) ontdekte onafhankelijk dezelfde wet in 1679. Maar het had de verdienste te laten zien dat het volume varieert met de temperatuur. Daarom heet het de wet van Mariotte of de wet van Boyle en Mariotte.
De wet versterken
Daniel Bernoulli (1737) versterkte de wet van Boyle door erop te wijzen dat de druk van een gas wordt veroorzaakt door de inslagen van gasdeeltjes op de wanden van de container waarin het zit..
In 1845 publiceerde John Waterston een wetenschappelijk artikel, waarin hij zich concentreert op de belangrijkste principes van de kinetische theorie van gassen.
Later consolideerden Rudolf Clausius, James Maxwell en Ludqwig Boltzmann de kinetische theorie van gassen, die de door een gas uitgeoefende druk in verband brengt met de snelheid van de deeltjes van het bewegende gas.
Hoe kleiner het volume van de houder die een gas bevat, hoe groter de frequentie van de inslagen van de deeltjes die het tegen de wanden van de houder vormen; en daarom, hoe groter de druk uitgeoefend door het gas.
Waar bestaat deze wet uit??
De experimenten uitgevoerd door Boyle wijzen erop dat er een omgekeerd verband bestaat tussen het volume dat wordt ingenomen door een gas en de druk die erop wordt uitgeoefend. De bovengenoemde relatie is echter niet volledig lineair, zoals aangegeven door een grafiek van de volumevariatie volgens de druk toegeschreven aan Boyle.
In de wet van Boyle wordt erop gewezen dat het volume dat wordt ingenomen door een gas omgekeerd evenredig is met de druk. Er wordt ook aangegeven dat het product van de druk van een gas door zijn volume constant is.
Wiskundige uitdrukking
Om tot de wiskundige uitdrukking van de wet Boyle-Mariotte te komen, vertrekken we van:
V α 1 / P
Waar het aangeeft dat het volume ingenomen door een gas omgekeerd evenredig is aan zijn druk. Er is echter een constante die dicteert hoe omgekeerd evenredig deze relatie is.
V = k / P
Waar k de constante van proportionaliteit is. K wissen heeft u:
VP = k
Het product van de druk van een gas door zijn volume is constant. dan:
V1P1 = k en V2P2 = k
En hieruit kan worden afgeleid dat:
V1P1 = V2P2
Dit laatste is de laatste uitdrukking of vergelijking voor de wet van Boyle.
Waar is het voor? Welke problemen loste de wet van Boyle op??
Stoommachines

De wet van Boyle-Mariotte is van toepassing op de werking van stoommachines. Het is een externe verbrandingsmotor die de transformatie van thermische energie van een hoeveelheid water in mechanische energie gebruikt.
Het water wordt verwarmd in een hermetisch afgesloten ketel en de geproduceerde stoom oefent een druk uit volgens de Boyle-Mariote wet die een volume-expansie van een cilinder produceert door een zuiger in te drukken.
De lineaire beweging van de zuiger wordt omgezet in een roterende beweging, door het gebruik van een systeem van cranks en cranks, dat de wielen van een locomotief of de rotor van een elektrische generator kan aandrijven.
Momenteel is de alternatieve stoommachine een weinig gebruikte motor, omdat deze door de elektromotor en de verbrandingsmotor in transportvoertuigen is verplaatst.
Nippend aan drankjes
De actie van het zuigen van een frisdrank of sap uit een fles door een plastic buis is gerelateerd aan de wet Boyle-Mariotte. Wanneer de lucht met behulp van de mond uit de buis wordt gezogen, neemt de druk in de buis af.
Deze drukval vergemakkelijkt de opwaartse beweging van de vloeistof in de buis, waardoor de opname ervan mogelijk wordt. Ditzelfde principe werkt bij de extractie van bloed door een spuit te gebruiken.
Ademhalingssysteem
De wet van Boyle-Mariotte is nauw verbonden met het functioneren van het ademhalingssysteem. Tijdens de inspiratiefase vindt samentrekking van het diafragma en andere spieren plaats; bijvoorbeeld de externe intercostals die een uitzetting van de ribbenkast produceren.
Dit veroorzaakt een afname van de intrapleurale druk, die een longuitzetting veroorzaakt die een toename van het longvolume veroorzaakt. Daarom neemt de intrapulmonaire druk af volgens wat in de wet Boyle-Mariotte staat.
Wanneer de intrapulmonaire druk subatmosferisch is, stroomt atmosferische lucht in de longen, resulterend in verhoogde druk in de longen; gelijk aan, zijn druk op de atmosferische druk, en het beëindigen van de fase van inspiratie.
Vervolgens ontspannen de inspiratorspieren en trekken de expiratoire spieren zich samen. Bovendien treedt pulmonale elastische retractie op, een verschijnsel dat een afname van het longvolume veroorzaakt, met als gevolg een toename van de intrapulmonaire druk, wat kan worden verklaard door de wet van Boyle-Mariotte..
Door de intrapulmonale druk te verhogen en groter te worden dan de atmosferische druk, stroomt lucht van de binnenkant van de longen de atmosfeer in. Dit gebeurt totdat de druk gelijk is, waardoor de expiratiefase wordt beëindigd.
Voorbeelden (experimenten)
Experiment 1
Een kleine ballon wordt stevig gesloten geplaatst, waarbij een knoop in zijn mond wordt gemaakt, in een injectiespuit, waaraan de plunjer is verwijderd, van ongeveer 20 ml. De plunjer van de spuit wordt in de richting van het middelste deel van de spuit geplaatst, de naald wordt verwijderd en de luchtinlaat wordt geblokkeerd.
observatie
Door langzaam aan de plunjer van de injector te trekken, wordt opgemerkt dat de ballon is opgeblazen.
toelichting
Er worden twee drukken op de wand van de ballon uitgeoefend: een druk op het binnenoppervlak, een product van de lucht in de ballon en een andere druk op het buitenvlak van de ballon, uitgeoefend door de lucht in de spuit.
Wanneer u aan de plunjer van de injector trekt, wordt er een halfvacuüm in gecreëerd. Daarom neemt de luchtdruk op het buitenoppervlak van de pompwand af, waardoor de druk binnen de pomp relatief groter wordt..
Deze netto druk, volgens de wet van Boyle-Mariote, zal een uitzetting van de ballonwand veroorzaken en een toename van het volume van de ballon.
Experiment 2
Snijd een plastic fles, ongeveer in de helft, en zorg ervoor dat de snede zo horizontaal mogelijk is. In de mond van de fles wordt een goed aangepaste ballon geplaatst, terwijl tegelijkertijd een bepaalde hoeveelheid water in een diepe schaal wordt geplaatst.
observatie
Door de bodem van de fles met de ballon op het water van de schaal te plaatsen, wordt de ballon matig opgeblazen.
toelichting
Het water verplaatst een bepaalde hoeveelheid lucht, waardoor de druk van de lucht op de wand van de fles en het binnenste van de ballon toeneemt. Dit veroorzaakt volgens de wet van Boyle-Mariotte een toename van het volume van de aarde, die wordt gevisualiseerd door de inflatie van de aarde.
referenties
- Wikipedia. (2019). De wet van Boyle. Teruggeplaatst van: en.wikipedia.org
- De redacteuren van Encyclopaedia Britannica. (27 juli 2018). De wet van Boyle. Encyclopædia Britannica. Teruggeplaatst van: britannica.com
- Helmenstine, Todd. (5 december 2018). De formule voor de wet van Boyle. Teruggeplaatst van: thoughtco.com
- Jonge Indiase films. (15 mei 2018). Boyle's Law: Science Experiment For Kids. Teruggeplaatst van: yifindia.com
- Cecilia Bembibre (22 mei 2011). Heteluchtballon Definitie ABC. Teruggeplaatst van: definicionabc.com
- Ganong, W, F. (2003). Medische fysiologie (19e editie). Redactioneel de moderne handleiding.


