Propyleen chemische structuur, eigenschappen en toepassingen
de propyleen of propeen bij kamertemperatuur en bij atmosferische druk is in een gasvormige toestand en is, net als andere alkenen, kleurloos. Het heeft een geur die lijkt op olie, maar van minder intensiteit. Het heeft een dipoolmoment sinds het, hoewel het een sterke polaire link mist, zijn molecuul asymmetrisch is.
Propyleen is ook een structureel isomeer van cyclopropaan (ze hebben dezelfde chemische formule C)3H6). Het komt in de natuur voor als gevolg van vegetatie en fermentatieprocessen. Kunstmatig ontstaat tijdens de verwerking van fossiele brandstoffen zoals olie, aardgas en, in mindere mate, koolstof.

Op dezelfde manier zijn ethyleen en propyleen producten van aardolieraffinage in een proces van het splitsen van grote koolwaterstofmoleculen om kleine koolwaterstoffen te produceren waar veel vraag naar is..
Propyleen kan ook worden verkregen met behulp van verschillende methodologieën:
- Reageren omkeerbaar ethyleen en buteen, waarbij de dubbele bindingen worden verbroken en opnieuw geformuleerd om propyleen te geven.
- Door een proces van dehydrogenatie (waterstofverlies) van propaan.
- Als onderdeel van een programma voor de productie van olefinen uit methanol (MTO) werd propeen geproduceerd uit methanol. Dit werd door de zeolietkatalysator gevoerd, wat de dehydratatie ervan bevordert en leidt tot de vorming van ethyleen en propyleen.
3CH3OH (methanol) => CH3CH = CH2 (propyleen) + 3H2O (water)
index
- 1 Chemische structuur
- 2 Eigenschappen
- 2.1 Molecuulgewicht
- 2.2 Kookpunt
- 2.3 Smeltpunt
- 2.4 Vlampunt
- 2.5 Oplosbaarheid
- 2.6 Oplosbaarheid uitgedrukt als massa
- 2.7 Dichtheid
- 2.8 Dampdichtheid
- 2.9 Dampspanning
- 2.10 Autoignition
- 2.11 Viscositeit
- 2.12 Verbrandingswarmte
- 2.13 Verdampingswarmte
- 2.14 Oppervlaktespanning
- 2.15 Polymerisatie
- 2.16 Vriespunt
- 2.17 Geurdrempel
- 3 Gebruik
- 3.1 Polypropyleen
- 3.2 Acrylonitril
- 3.3 Propyleenoxide
- 3.4 Voor de synthese van alcoholen en andere toepassingen
- 4 Referenties
Chemische structuur
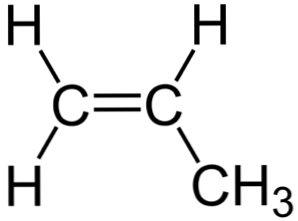
In de bovenstaande afbeelding is de chemische structuur van propyleen te zien, waarbij de asymmetrie ervan opvalt (de rechterkant is anders dan de linkerzijde). Het koolstofskelet, exclusief de H-atomen, kan worden waargenomen als een boemerang.
Deze boemerang vertoont een onverzadigde of dubbele binding aan één van zijn zijden (de C1) en daarom is het vlak vanwege sp-hybridisatie2 van koolstofatomen.
De andere kant wordt echter ingenomen door de methylgroep (-CH3), waarvan de hybridisatie sp3 en het heeft een tetraëdrische geometrie. Aldus gezien vanaf de voorkant, is de boemerang vlak en steken de H-atomen ongeveer uit bij ongeveer 109,5 °.
In de gasfase reageert het molecuul zwak met anderen door dispersiekrachten. Ook worden de interacties tussen de dubbele bindingen (π-π) van twee propyleenmoleculen voorkomen door de methylgroep.
Dit resulteert in een afname van hun intermoleculaire krachten, wat wordt weerspiegeld in hun fysieke eigenschappen. Alleen bij zeer lage temperaturen kan propyleen een vaste structuur aannemen, waarbij de boemerans gegroepeerd blijven met hun zwakke interacties.
eigenschappen
Het is een kleurloos gas met een aromatische geur. Het wordt vervoerd in de vorm van vloeibaar gemaakt gas en wanneer het uit de containers die het bevatten ontsnapt, doet het dat in de vorm van gas of vloeistof. Bij lage concentraties vormt het een explosief en ontvlambaar mengsel met lucht, waarbij de dichtheid van propyleen hoger is dan die van lucht.
Moleculair gewicht
42.081 g / mol
Kookpunt
53,9 ºF tot 760 mmHg
48 ºC tot 760 mmHg
Smeltpunt
301.4 ºF
185 ºC
Vlampunt
162 ºF
oplosbaarheid
44,6 ml / 100 ml in water.
1250 ml / 100 ml in ethanol.
524,5 ml / 100 ml in azijnzuur.
Oplosbaarheid uitgedrukt als massa
200 mg / l 25 ºC
dichtheid
0.609 mg / ml bij -52.6º F
0,5139 bij 20 ° C
Dampdichtheid
1,46 tot 32 ° F (ten opzichte van de lucht als referentie).
1,49 (lucht = 1).
1,91 kg / m3 tot 273,15 ºK
Stoom druk
1 mmHg bij -205.4ºF
760 mmHg tot -53,9 ° F
8.69 × 103 mmHg bij 25 ºC (geëxtrapoleerde waarde).
1.158 kPa bij 25 ºC
15,4 atm bij 37 ºC
zelfontbranding
851 ºF
455 ºC
viscositeit
83,4 micropoise bij 16,7 ° C.
Warmte van verbranding
16,692 BTU / lb
10.940 cal / g
Verdampingswarmte
104.62 cal / g (bij het kookpunt)
Oppervlaktespanning
16,7 dynes / cm bij 90 ° C
polymerisatie
Polymeriseert bij hoge temperaturen en hoge drukken in de aanwezigheid van katalysatoren.
Vriespunt
185,25 ° C.
Geurdrempel
10-50 mg / m3 (Detectie)
100 mg / m3 (Recognition)
toepassingen

Het wordt in de petrochemische industrie gebruikt als brandstof en alkyleringsmiddel. In de chemische industrie wordt het gebruikt als grondstof voor de productie en synthese van talrijke derivaten.
Het heeft vooral nut bij de productie van polypropyleen, acrylonitril (ACN), propyleenoxide (PO), alcoholen, cumeen en acrylzuren..
polypropyleen
Polypropyleen is een van de belangrijkste plastic materialen met gebruik in elektronica en elektrische accessoires, huishoudelijke artikelen, doppen en koffers.
Het gelamineerde materiaal wordt gebruikt bij het verpakken van snoepjes, etiketten, cd's, enz., Terwijl vezels worden gemaakt van mappen en kleding..
acrylonitril
Elastomere polymeren en vezels worden verkregen uit acrylonitril. Deze vezels zijn bedoeld voor de vervaardiging van verschillende soorten kleding, zoals truien, sokken en sportkleding. Ze worden ook gebruikt in huismeubilair, in mappen, stoffering, kussens en dekens.
Propyleenoxide
Propyleenoxide neemt deel als een component in de synthese van polyurethaan. Dit wordt gebruikt bij de vervaardiging van flexibel schuim en hard schuim. Flexibel schuim wordt gebruikt als opvulling voor huismeubilair en in de auto-industrie.
Aan de andere kant wordt hardschuim hoofdzakelijk gebruikt als bouwisolatiemateriaal.
Bovendien wordt propyleenoxide gebruikt bij de productie van propyleenglycol. Deze verbinding wordt gebruikt bij de vervaardiging van onverzadigde polyesterharsen en als antivriesmiddel.
Bovendien wordt propyleenoxide gebruikt bij de productie van propyleenglycolether. Deze ether is toepasbaar bij de productie van verven, kleding, inkten, harsen en reinigingsmiddelen.
Voor de synthese van alcoholen en andere toepassingen
Propyleen maakt het mogelijk een aantal alcoholen te verkrijgen, waaronder isopropanol, gebruikt als oplosmiddel in cosmetica en producten voor persoonlijke verzorging. Bovendien vervult het de functie van antiseptisch middel.
- Isopropanol is betrokken bij de productie van verven, harsen, inkten en kleefbanden. Het wordt ook gebruikt in de farmaceutische industrie.
- Oxo-alcohol2-ethylhexanol wordt gebruikt bij de productie van ftalaten, weekmakers, hechtmiddelen en verven.
- Butanol wordt gebruikt bij de vervaardiging van verven, coatings, harsen, kleurstoffen, farmaceutische producten en polymeren.
Aan de andere kant wordt cumeen geproduceerd uit de combinatie van propyleen en benzeen. Cumeen is de belangrijkste verbinding bij de vervaardiging van fenol en aceton, gebruikt in een verscheidenheid aan producten, zoals polycarbonaten, fenolharsen, epoxyharsen en methylmethacrylaat..
Ten slotte wordt acrylzuur - een ander product dat is afgeleid van propyleen - gebruikt voor de productie van acrylesters en harsen voor verven, coatings en lijmtoepassingen..
referenties
- Michal Osmenda (26 december 2007). Steek mijn vuur aan. [Afbeelding]. Opgehaald op 23 mei 2018, van: commons.wikimedia.org
- De Linde Group. (2018). Propyleen. Opgehaald op 23 mei 2018, van: linde-gas.com
- Wikipedia. (2018). Propeen. Opgehaald op 23 mei 2018, vanaf: en.wikipedia.org
- PubChem. (2018). Propyleen. Opgehaald op 27 mei 2018, van: pubchem.ncbi.nlm.nih.gov
- Vesovic Velisa. (7 februari 2011). Propyleen. Opgehaald op 27 mei 2018, vanaf: thermopedia.com
- Jeffrey S. Plotkin. (8 augustus 2016). Het Propyleen-dilemma. Opgehaald op 27 mei 2018, vanuit: acs.org
- ICIS. (6 november 2017). Gebruik van propyleen en marktgegevens. Opgehaald op 27 mei 2018, vanaf: icis.com


