Wat is een neutraal atoom? (Met voorbeelden)
een neutraal atoom is dat wat geen elektrische lading heeft als gevolg van een compensatie tussen het aantal protonen en elektronen. Beide zijn elektrisch geladen subatomaire deeltjes.
Protonen zijn geagglomereerd naast neutronen en vormen de kern; terwijl de elektronen worden verspreid door een elektronische wolk te definiëren. Wanneer het aantal protonen in een atoom, gelijk aan het atoomnummer (Z), gelijk is aan het aantal elektronen, wordt er gezegd dat er een compensatie is tussen de elektrische ladingen binnen het atoom.
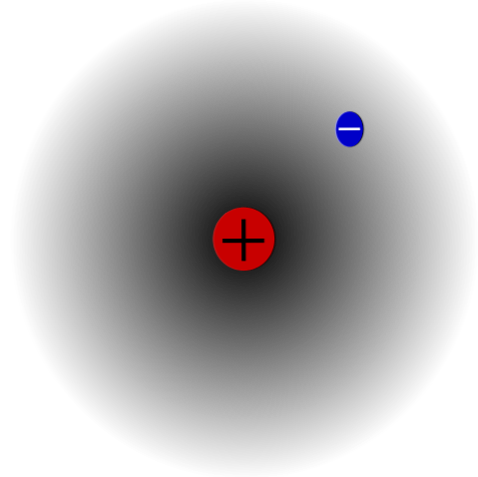
Er is bijvoorbeeld een waterstofatoom (bovenste afbeelding), dat een proton en een elektron heeft. Het proton is als kern in het midden van het atoom geplaatst, terwijl het elektron de omringende ruimte rondloopt, waardoor gebieden met een lagere elektronendichtheid achterblijven als het zich van de kern verwijdert.
Dit is een neutraal atoom omdat het waar is dat Z gelijk is aan het aantal elektronen (1p = 1e). Als het H-atoom dat ene proton zou verliezen, zou de atoomstraal kleiner worden en de protonlading zou de overhand krijgen, en zou het H-kation worden.+ (Hydron). Als, aan de andere kant, het een elektron krijgt, zouden er twee elektronen zijn en zou het het H-anion worden-- (Hydride).
index
- 1 Neutraal atoom versus ion
- 1.1 Na vs Na+
- 2 neutrale moleculen
- 3 voorbeelden
- 3.1 Zuurstof
- 3.2 Koper
- 3.3 Nobele gassen
- 3.4 Metaallegeringen
- 4 Referenties
Neutraal atoom versus ion
Voor het voorbeeld van het neutrale atoom van H werd gevonden dat het aantal protonen gelijk is aan het aantal elektronen (1p = 1e); situatie die niet optreedt met de ionen afgeleid door het verlies of de winst van een elektron.
Ionen worden gevormd door een verandering in het aantal elektronen, ofwel omdat het atoom ze (-) wint of verliest (+).
In het atoom van het kation H+ De valentie lading van het solitaire proton overheerst voor de totale afwezigheid van een elektron (1p> 0e). Dit geldt voor alle andere zwaardere atomen (np> ne) van het periodiek systeem.
Hoewel de aanwezigheid van een positieve lading onbeduidend lijkt, verandert deze diagonaal de kenmerken van het element in kwestie.
Aan de andere kant, in het anionatoom H- De negatieve lading van de twee elektronen overheerst voor het proton met enkele kern (1 p<2e). Igualmente, los demás aniones de mayor masa tienen un exceso de electrones en comparación al número de protones (np
Na versus Na+
Een beter bekend voorbeeld is dat van metallisch natrium. Het neutrale atoom, Na, met Z = 11, heeft 11 protonen; daarom moeten er 11 elektronen zijn om de positieve ladingen te compenseren (11p = 11e).
Natrium, dat een metaalachtig element is, zeer elektropositief, verliest zeer gemakkelijk zijn elektronen; in dit geval verliest hij er slechts één, die van zijn valentie schaal (11p> 10e). Aldus wordt het Na-kation gevormd+, die elektrostatisch interageert met een anion; zoals chloride, Cl-, in het zout natriumchloride, NaCl.
Metallisch natrium is giftig en bijtend, terwijl het kation ervan zelfs in de cellen aanwezig is. Dit laat zien hoe de eigenschappen van een element drastisch kunnen variëren als het elektronen wint of verliest.
Aan de andere kant, de Na-anion- (soduro, hypothetisch) bestaat niet; en om te kunnen vormen, zou het extreem reactief zijn, omdat het tegen de chemische aard van natrium is om elektronen te verkrijgen. De Na- zou 12 elektronen hebben, die de positieve lading van zijn kern overtreffen (11p<12e).
Neutrale moleculen
Atomen zijn covalent gebonden om moleculen te vormen, die ook verbindingen kunnen worden genoemd. Er kunnen geen geïsoleerde ionen in een molecuul zijn; in plaats daarvan zijn er atomen met positieve of negatieve formele ladingen. Deze geladen atomen beïnvloeden de netto lading van het molecuul en transformeren het in een polyatomisch ion.
Wil een molecuul neutraal zijn, dan moet de som van de formele ladingen van zijn atomen gelijk zijn aan nul; of, eenvoudiger gezegd, al zijn atomen zijn neutraal. Als de atomen waaruit een molecuul bestaat neutraal zijn, zal dit ook zo zijn.
U hebt bijvoorbeeld het watermolecuul, H2O. Zijn twee H-atomen zijn neutraal, net als het zuurstofatoom. Ze kunnen niet op dezelfde manier worden weergegeven als in de afbeelding van het waterstofatoom; omdat, hoewel de kern niet verandert, de elektronische cloud dat wel doet.
Het hydronium-ion, H3O+, aan de andere kant heeft het een zuurstofatoom met gedeeltelijke positieve lading. Dit betekent dat in dat polyatomaire ion het een elektron verliest, en daarom is zijn aantal protonen groter dan dat van zijn elektronen.
Voorbeelden
zuurstof
Het neutrale zuurstofatoom heeft 8 protonen en 8 elektronen. Wanneer het twee elektronen krijgt, vormt het wat bekend staat als anionoxide, OF2-. Hierin domineren negatieve ladingen, met een overmaat van twee elektronen (8p<10e).
Neutrale zuurstofatomen hebben een hoge neiging om te reageren en zichzelf te binden om O te vormen2. Het is om die reden dat daar geen atomen zijn of "los" zijn aan hun lot en zonder iets te reageren. Alle bekende reacties voor dit gas worden toegeschreven aan moleculaire zuurstof, OF2.
koperen
Koper heeft 29 protonen en 29 elektronen (naast neutronen). In tegenstelling tot zuurstof kunnen de neutrale atomen in de natuur worden gevonden vanwege hun metaalbinding en relatieve stabiliteit.
Net als natrium heeft het de neiging om elektronen te verliezen in plaats van ze te winnen. Gegeven zijn elektronische configuratie en andere aspecten, kan het één of twee elektronen verliezen, waardoor koper (koper) kationen, Cu+, of cupric, Cu2+, respectievelijk.
Het koper+ heeft één minder elektron (29p<28e), y el Cu2+ heeft twee elektronen verloren (29p<27e).
Nobele gassen
De edelgassen (He, Ne, Ar, Kr, Xe, Rn) zijn een van de weinige elementen die bestaan in de vorm van hun neutrale atomen. Hun atoomnummers zijn respectievelijk: 2, 10, 18, 36, 54 en 86. Ze verwerven of verliezen geen elektronen; hoewel Xenon, Xe verbindingen met fluor kan vormen en elektronen kan verliezen.
Metaallegeringen
Metalen, beschermd tegen corrosie, kunnen hun neutrale atomen behouden, verbonden door metaalverbindingen. In legeringen, vaste oplossingen van metalen, blijven de atomen (meestal) neutraal. In messing zijn er bijvoorbeeld neutrale atomen van Cu en Zn.
referenties
- Jetser Carasco. (2016). Wat is een neutraal atoom? Teruggeplaatst van: introduction-to-physics.com
- Markeringen, Samuel. (25 april 2017). Niet-neutrale atomen voorbeelden. Sciencing. Teruggeplaatst van: sciencing.com
- Chem4Kids. (2018) Kijkend naar Ions. Teruggeplaatst van: chem4kids.com
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e druk). CENGAGE Leren.
- Shiver & Atkins. (2008). Anorganische chemie (Vierde editie). Mc Graw Hill.


