Natriumsulfaatformule, eigenschappen, structuur, toepassingen
de natriumsulfaat (dinatriumzout van zwavelzuur, dinatriumtetraoxidosulfaat, sulfaat van soda, zout van Glauber, thenardite, mirabiliet) is de anorganische verbinding met de formule Na2SW4 en de bijbehorende hydraten. Alle vormen zijn witte vaste stoffen die sterk oplosbaar zijn in water.
Het wordt beschouwd als een van de belangrijkste op de markt gebrachte chemische producten. De wereldwijde productie (bijna uitsluitend in de vorm van decahydraat) bedraagt ongeveer 6 miljoen ton per jaar.

Thenardiet is het watervrije natriumsulfaatmineraal dat wordt geproduceerd in droge verdampingsomgevingen, in droge grotten, in oude mijnactiviteiten als uitbloeiing en als afzetting rond fumarolen.
Het werd voor het eerst beschreven in 1825 in Salinas Espartinas (Ciempozuelos, Madrid, Spanje) en heette thenardita ter ere van de Franse chemicus Louis Jacques Thénard (1777-1826).

Nederlandse / Duitse apotheek en drogist Rudolf Johann Glauber (1604-1670) in 1625 ontdekt in het water van een Oostenrijkse lente, natriumsulfaat decahydraat (later genoemd glauberzout). Hij noemde het zout mirabilis (wonderbaarlijke zout), vanwege de geneeskrachtige eigenschappen.
Tussen 1650 en 1660 begon Glauber natriumsulfaat te produceren uit keukenzout (NaCl) en geconcentreerd zwavelzuur. Dit proces wordt beschouwd als het begin van de chemische industrie.
De kristallen werden tot de 20e eeuw als laxeermiddel gebruikt.
In de achttiende eeuw begon de reactie van Glauber's zout met kalium (kaliumcarbonaat) te worden gebruikt bij de industriële productie van natriumcarbonaat (natriumcarbonaat).

Het wordt momenteel hoofdzakelijk gebruikt voor de vervaardiging van detergentia en in het Kraft-proces voor de productie van papierpulp (de dominante methode bij de productie van papier).
Natriumsulfaat minerale afzettingen zijn te vinden in de Verenigde Staten, Canada, Spanje, Italië, Turkije, Roemenië, Mexico, Botswana, China, Egypte, Mongolië en Zuid-Afrika.
De belangrijkste producenten zijn China (provincies Jiangsu en Sichuan), gevolgd door Spanje, waar de grootste hoeveelheid glauberietafzetting ter wereld ligt (in Cerezo de Río Tirón, Burgos).
De totale wereldproductie van natuurlijk natriumsulfaat wordt geschat op ongeveer 8 miljoen ton, en die verkregen als bijproduct van andere industriële processen tussen 2 en 4 Mt.
In Spanje, volgens de informatie over de Nationale Resource Inventory sulfaat en andere bijgewerkte gegevens, voorraden mineralen natrium sulfaat in de orde van 730 Mt vermeld als "reserves" worden geschat en 300 Mt geclassificeerd als "andere middelen".
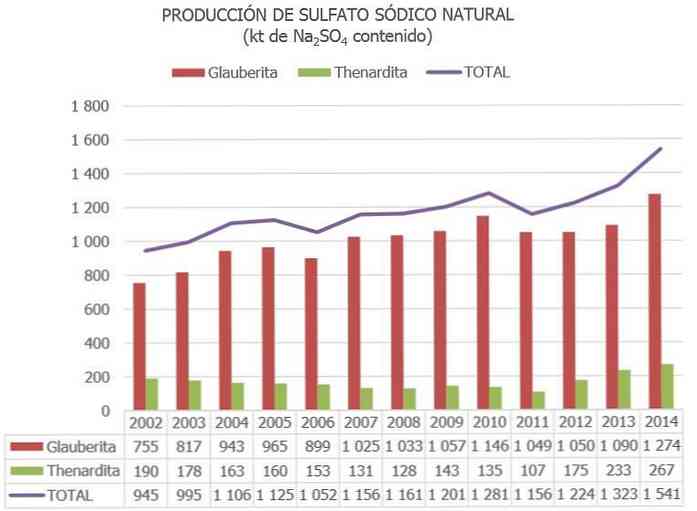
In de Europese Unie is Spanje momenteel het enige land met ertsen natriumsulfaat (voornamelijk van Thenardite, Glauberite en Mirabilite).
Momenteel is er een algemene daling van de vraag naar natriumsulfaat in de textielsector.
In de afgelopen jaren hebben andere sectoren, zoals detergentia, in bepaalde regio's enige groei doorgemaakt vanwege hun lage prijs als grondstof.
De belangrijkste groeimarkten voor natriumsulfaatdetergentia zijn te vinden in Azië, Midden-Amerika en Zuid-Amerika.
formules

2D-structuur
3D-structuur
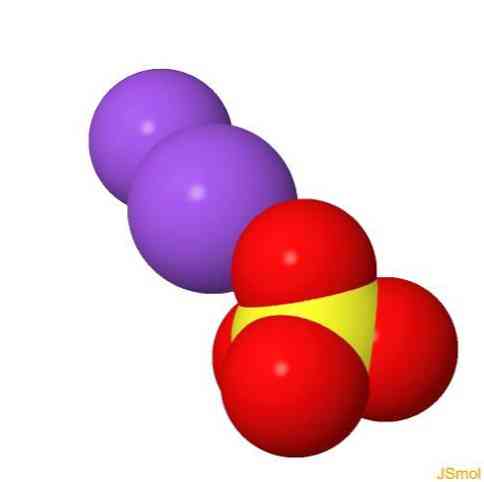
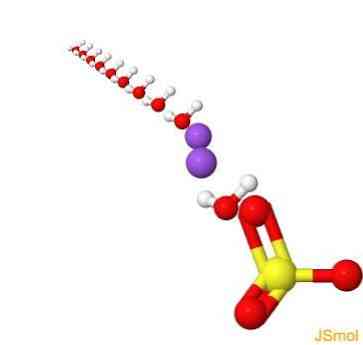
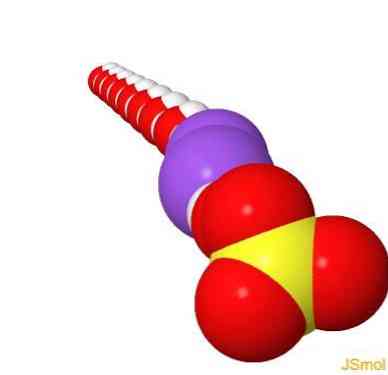
features
Fysische en chemische eigenschappen
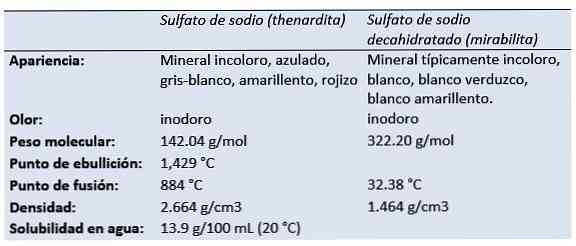
Natriumsulfaat behoort tot de reactieve groep van natriumverbindingen en behoort ook tot de groep van sulfaten, waterstofsulfaten en disulfieten.
ontvlambaarheid
Het is een niet-brandbare substantie. Er is geen risico op ontploffing van de poeders.
reactiviteit
Natriumsulfaat is zeer oplosbaar in water en hygroscopisch. Het is zeer stabiel en is niet reactief voor de meeste oxiderende of reducerende stoffen bij normale temperaturen. Bij hoge temperaturen kan het worden omgezet in natriumsulfide door middel van carbothermale reductie.
Chemisch niet-reactieve stoffen worden als niet-reactief beschouwd onder typische omgevingscondities (hoewel ze kunnen reageren in relatief extreme omstandigheden of in katalyse). Ze zijn bestand tegen oxidatie en reductie (behalve in extreme omstandigheden).
Gevaarlijke chemische reacties
Wanneer aluminium wordt gesmolten samen met natrium- of kaliumsulfaat, treedt een hevige explosie op.
toxiciteit
Chemisch niet-reactieve stoffen worden als niet-toxisch beschouwd (hoewel gasvormige stoffen uit deze groep als verstikkend kunnen werken).
Hoewel natriumsulfaat over het algemeen als niet-toxisch wordt beschouwd, moet het voorzichtig worden behandeld. Het poeder kan astma of tijdelijke oogirritatie veroorzaken. Dit risico kan worden vermeden door oogbescherming en een papieren masker te dragen.
toepassingen
De belangrijkste toepassingen zijn bij de vervaardiging van:
- waspoeder.
- papierpulp.
- textiel.
- glas.
- synthese van enzymen (wijnbereiding).
- menselijke en dierlijke voeding.
- apotheek producten.
- algemene chemie in het algemeen.
- staalprocessen.
- Waspoeder
Natriumsulfaat is een zeer goedkoop materiaal. Het grootste gebruik is als een vulmiddel in huishoudelijke poedervormige reinigingsmiddelen, consumeren ca.. 50% van de wereldproductie. De nieuwe compacte of vloeibare wasmiddelen bevatten geen natriumsulfaat, dus dit gebruik neemt af.
Een ander gebruik van natriumsulfaat dat in belang afneemt, vooral in de VS. en Canada, zit in het Kraft-proces voor de productie van houtpulp. Vooruitgang in de thermische efficiëntie van het proces verminderde de behoefte aan natriumsulfaat drastisch.
De glasindustrie biedt een andere belangrijke toepassing voor natriumsulfaat. Het is de op een na grootste toepassing in Europa. Natriumsulfaat wordt gebruikt om kleine luchtbellen uit gesmolten glas te verwijderen.
In Japan is de grootste toepassing van natriumsulfaat in de vervaardiging van textiel. Natriumsulfaat helpt de kleurstoffen gelijkmatig in de vezels te dringen en tast de roestvrijstalen vaten die worden gebruikt bij het verven niet aan (in tegenstelling tot natriumchloride, de alternatieve methode).
Natriumsulfaat is met name geschikt voor het opslaan van lage kwaliteit zonnewarmte (voor latere afgifte in verwarmingstoepassingen) vanwege zijn hoge warmteopslagcapaciteit tijdens de faseverandering van vast naar vloeibaar, die wordt gegeven bij 32 ° C.
Voor koeltoepassingen vermindert een mengsel met natriumchloride (NaCl) keukenzout het smeltpunt tot 18 ° C.
In het laboratorium wordt watervrij natriumsulfaat veel gebruikt als inert droogmiddel om sporen water uit organische oplossingen te verwijderen. De werking ervan is langzamer dan die van magnesiumsulfaat, maar het kan worden gebruikt met een verscheidenheid aan materialen omdat het chemisch vrij inert is.
Natriumsulfaatdecahydraat (Glauber's zout) werd historisch gebruikt als laxeermiddel. Het is effectief voor de eliminatie van bepaalde geneesmiddelen, zoals paracetamol (acetaminophen) uit het lichaam na een overdosis.
Andere toepassingen voor natriumsulfaat omvatten het gebruik ervan als een additief bij de vervaardiging van tapijt-luchtverfrissers, als een toevoegsel in veevoer en bij de vervaardiging van zetmeel.
Klinische effecten
Voor zijn therapeutische toepassingen, behoort natriumsulfaat tot de categorie van zoutoplossing en cathartische laxeermiddelen die worden gebruikt bij de behandeling van obstipatie.
Zoutharmkoloniën zijn zouten die vloeistoffen in de darm behouden door de osmotische werking van het niet-geabsorbeerde zout, waardoor de peristaltiek indirect toeneemt.
Zouthoudende aparaten worden slecht geabsorbeerd door het maagdarmkanaal, daarom is systemische toxiciteit onwaarschijnlijk tenzij er grote hoeveelheden zijn ingenomen. Grote blootstellingen kunnen echter uitdroging en elektrolytveranderingen veroorzaken die secundair zijn aan de osmotische effecten van de verbinding.
Chronisch laxerend misbruik kan voorkomen bij patiënten met een eetstoornis, het Munchausen-syndroom of bij kunstmatige aandoeningen. Over het algemeen ervaren patiënten misselijkheid, braken en diarree in verband met buikkrampen. Ernstige effecten kunnen dehydratie, hypotensie, hypernatriëmie en elektrolytafwijkingen zijn.
Beveiliging en risico's
Gevaaraanduidingen van het wereldwijd geharmoniseerd systeem voor classificatie en etikettering van chemische stoffen (SGA).
Het wereldwijd geharmoniseerd systeem voor de indeling en etikettering van chemische stoffen (GHS) is een internationaal overeengekomen systeem, gecreëerd door de Verenigde Naties ontworpen om de verschillende standaarden en etikettering wordt gebruikt in de verschillende landen op basis van consistente criteria wereldwijd (Nations vervangen United, 2015).
Gevarenklassen (en de bijbehorende hoofdstuk van de GHS) criteria voor de indeling en etikettering en aanbevelingen voor natriumsulfaat zijn als volgt (European Chemicals Agency, 2017, de Verenigde Naties, 2015; PubChem, 2017):
Gevarenklassen van het GHS
H315: Veroorzaakt huidirritatie [Waarschuwing Huidcorrosie / -irritatie - Categorie 2].
H317: Kan een allergische huidreactie veroorzaken [Waarschuwing Sensibilisatie, Huid - Categorie 1].
H319: Veroorzaakt ernstige oogirritatie [Waarschuwing Ernstig oogletsel / oogirritatie - Categorie 2A].
H412: Schadelijk voor in het water levende organismen met langdurige nadelige effecten [Gevaarlijk voor het aquatisch milieu, langetermijnrisico - Categorie 3].
(PubChem, 2017)
Codes van de prudentiële raden
P261, P264, P272, P273, P280, P302 + P352, P351 + P338 + P305, P321, P332 + P313, P333 + P313, P337 + P313, P362, P363, P501 en.
referenties
- ChemIDplus (2017) 3D-structuur van 7757-82-6 - watervrij natriumsulfaat [afbeelding]. Teruggeplaatst van: chem.nlm.nih.gov.
- ChemIDplus (2017) 3D-structuur van 7727-73-3 - Natriumsulfaat [USP] [afbeelding]. Teruggeplaatst van: chem.nlm.nih.gov.
- Dyet, D. (2007) Thenardite Sodium sulfate near Sodaville Mineral County Nevada [afbeelding] Verkregen van: en.wikipedia.org.
- Europees Agentschap voor chemische stoffen (ECHA), (2017). Samenvatting van classificatie en etikettering. Geharmoniseerde indeling - Bijlage VI van Verordening (EG) nr. 1272/2008 (CLP-verordening). Natriumsulfaat.
- Grumetisho (2012) Mirabilita [afbeelding] Teruggeplaatst van: es.wikipedia.org.
- Databank Gevaarlijke Stoffen (HSDB). TOXNET. (2017). Natriumsulfaat Bethesda, MD, EU: National Library of Medicine. Teruggeplaatst van: toxnet.nlm.nih.gov.
- Geologisch en mijninstituut van Spanje (IGME) (2016). GLAUBERITA-THENARDITA (NATUURLIJK SODIUM SULFATE) 2014. Mijnpanorama. Teruggeplaatst van: igme.es.
- Nationaal Instituut voor de veiligheid op het werk (INSHT). (2010). International Safety Chemical Records. Natriumsulfaat. Ministerie van werkgelegenheid en veiligheid. Madrid. Het is. Teruggeplaatst van: insht.es.
- Langbein Rise (2008) Continuous kraft pulp mil [afbeelding] Geïnteresseerd in: wikimedia.org.
- Verenigde Naties (2015). Globaal geharmoniseerd systeem voor classificatie en etikettering van chemische producten (SGA) Zesde herziene editie. New York, Verenigde Staten: publicatie van de Verenigde Naties. Teruggeplaatst van: unece.org.
- Nationaal centrum voor informatie over biotechnologie. PubChem Compound Database (2016) natriumsulfaat - PubChem Structure [afbeelding] Bethesda, MD, EU: National Library of Medicine. Teruggeplaatst van: pubchem.ncbi.nlm.nih.gov.
- Nationaal centrum voor informatie over biotechnologie. PubChem Compound Database (2016) natriumsulfaat - PubChem Structure [afbeelding] Bethesda, MD, EU: National Library of Medicine.
- Nationaal centrum voor informatie over biotechnologie. PubChem Compound-database. (2017). Natriumsulfaat decahydrated. Bethesda, MD, EU: National Library of Medicine. Teruggeplaatst van: pubchem.ncbi.nlm.nih.gov.
- Nationaal centrum voor informatie over biotechnologie. PubChem Compound-database. (2017). Natriumsulfaat Bethesda, MD, EU: National Library of Medicine. Teruggeplaatst van: pubchem.ncbi.nlm.nih.gov.
- Walkerma (2005) Natriumsulfaat [afbeelding] Geïnteresseerd in: wikimedia.org.
- Wikipedia (2017) Kraft-proces. Teruggeplaatst van: wikipedia.org.
- Wikipedia (2017) Mirabilita. Teruggeplaatst van: wikipedia.org.
- Wikipedia (2017) Mirabilite. Teruggeplaatst van: wikipedia.org.
- Wikipedia (2017) Natriumsulfaat. Teruggeplaatst van: wikipedia.org.
- Wikipedia (2017) Solfato di sodium-decaidrate. Teruggeplaatst van: https://it.wikipedia.org.
- Wikipedia (2017) Natriumsulfaat. Teruggeplaatst van: wikipedia.org.
- Wikipedia (2017) Thenardita. Teruggeplaatst van: wikipedia.org.
- Wikipedia (2017) Thenardite. Teruggeplaatst van: .wikipedia.org.


