Boriumoxide (B2O3) structuur, eigenschappen, nomenclatuur en toepassingen
de booroxide of boorzuuranhydride is een anorganische verbinding waarvan de chemische formule B is2O3. Als de boor- en zuurstofelementen van het p-blok van het periodiek systeem, en zelfs meer hoofden van hun respectieve groepen, is het verschil in elektronegativiteit daartussen niet erg hoog; daarom valt te verwachten dat de B2O3 covalent van aard zijn.
De B2O3 het wordt bereid door borax op te lossen in geconcentreerd zwavelzuur in een smeltoven en bij een temperatuur van 750 ° C; thermisch dehydrateren van boorzuur, B (OH)3, bij een temperatuur van ongeveer 300 ° C; of het kan ook worden gevormd als een product van de diboraanreactie (B.2H6) met zuurstof.

Boriumoxide kan een semitransparant glasachtig of kristallijn uiterlijk hebben; Dit laatste kan worden verkregen door in poedervorm te malen (bovenste afbeelding).
Hoewel het op het eerste gezicht misschien niet lijkt, wordt het als B beschouwd2O3 als een van de meest complexe anorganische oxiden; niet alleen vanuit een structureel oogpunt, maar ook vanwege de variabele eigenschappen die brillen en keramiek verkrijgen, waaraan ze worden toegevoegd aan hun matrix.
index
- 1 Structuur van booroxide
- 1.1 Unit BO3
- 1.2 Kristalstructuur
- 1.3 Glasachtige structuur
- 2 Eigenschappen
- 2.1 Fysiek uiterlijk
- 2.2 Molecuulmassa
- 2.3 Smaak
- 2.4 Dichtheid
- 2.5 Smeltpunt
- 2.6 Kookpunt
- 2.7 Stabiliteit
- 3 Nomenclatuur
- 4 Gebruik
- 4.1 Synthese van boortrihalogeniden
- 4.2 Insecticide
- 4.3 Oplosmiddel van metaaloxiden: vorming van glas, keramiek en boorlegeringen
- 4.4 Binder
- 5 Referenties
Structuur van booroxide
BO-eenheid3
De B2O3 is een covalente vaste stof, dus in theorie zijn er geen B-ionen in de structuur3+ noch O2-, maar B-O-koppelingen. Borium kan volgens de valentiebindingstheorie (VTE) alleen drie covalente bindingen vormen; in dit geval drie B-O-koppelingen. Als gevolg hiervan moet de verwachte geometrie trigonaal zijn, BO3.
Het BO-molecuul3 het heeft een tekort aan elektronen, met name zuurstofatomen; meerdere van deze kunnen echter met elkaar interageren om genoemde tekortkoming te leveren. Dus de driehoeken BO3 ze voegen zich bij elkaar door een zuurstofbrug te delen, en ze worden in de ruimte verdeeld als driehoekige rijnetwerken met hun vliegtuigen op verschillende manieren georiënteerd.
Kristalstructuur
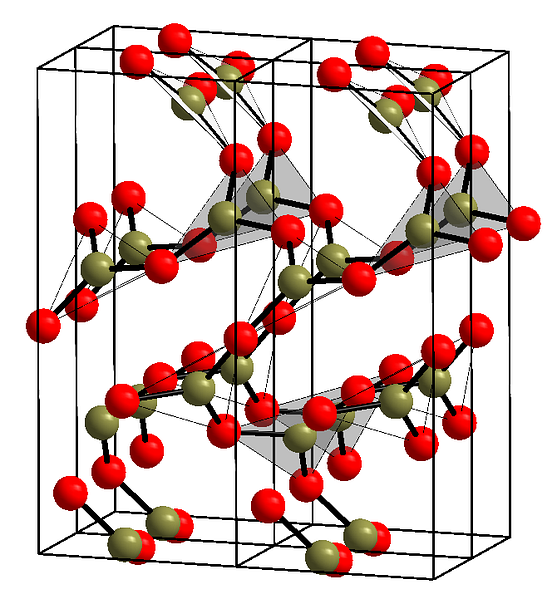
De bovenste afbeelding toont een voorbeeld van de rijen met driehoekige eenheden BO3. Als je goed kijkt, wijzen niet alle vlakken van de vlakken naar de lezer, maar naar een andere kant. De oriëntaties van deze gezichten kunnen verantwoordelijk zijn voor hoe de B is gedefinieerd2O3 bij een bepaalde temperatuur en druk.
Wanneer deze netwerken een structureel patroon op lange termijn hebben, is het een kristallijne vaste stof, die kan worden geconstrueerd vanuit zijn eenheidscel. Dit is waar de B wordt gezegd te zijn2O3 Het heeft twee kristallijne polymorfen: de α en de β.
De α-B2O3 treedt op bij omgevingsdruk (1 atm) en er wordt gezegd dat het kinetisch onstabiel is; in feite is dit een van de redenen waarom boriumoxide waarschijnlijk een verbinding is van moeilijke kristallisatie.
De andere polymorf, β-B2O3, het wordt verkregen bij hoge drukken in het bereik van GPa; daarom moet de dichtheid groter zijn dan die van a-B2O3.
Glasachtige structuur
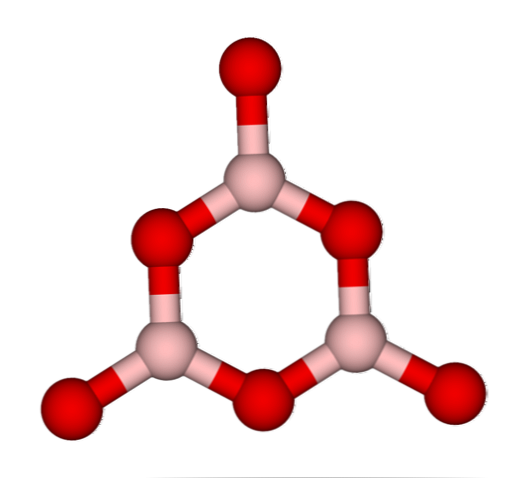
De netwerken BO3 van nature neigen ze naar amorfe structuren; deze zijn, die een patroon missen dat de moleculen of ionen in de vaste stof beschrijft. Door de B te synthetiseren2O3 de overheersende vorm is amorf en niet kristallijn; in correcte woorden: het is een solide meer glasachtig dan kristallijn.
Er wordt dan gezegd dat de B2O3 het is glasachtig of amorf wanneer zijn BO-netwerken3 Ze zijn rommelig. Niet alleen dit, maar ook, ze veranderen de manier waarop ze samenkomen. In plaats van geordend te zijn in een trigonale geometrie, worden ze uiteindelijk gekoppeld om te creëren wat onderzoekers een boroxolring noemen (bovenste afbeelding).
Let op het voor de hand liggende verschil tussen driehoekige en zeshoekige eenheden. De driehoekige kenmerken de B2O3 kristallijn en hexagonaal naar B2O3 glasvocht. Een andere manier om naar deze amorfe fase te verwijzen is boorglas of een formule: g-B2O3 (de 'g' komt van het woord glasachtig, in het Engels).
Dus de G-B-netwerken2O3 ze zijn samengesteld uit boroxolringen en geen BO-eenheden3. Echter, de g-B2O3 kan kristalliseren tot a-B2O3, wat een interconversie van ringen naar driehoeken zou impliceren, en ook de bereikte graad van kristallisatie bepalen.
eigenschappen
Uiterlijke verschijning
Het is een kleurloze en glasachtige vaste stof. In zijn kristallijne vorm is het wit.
Moleculaire massa
69,6182 g / mol.
smaak
Enigszins bitter
dichtheid
-Kristallijn: 2,46 g / ml.
-Glasachtig: 1,80 g / ml.
Smeltpunt
Het heeft geen volledig gedefinieerd smeltpunt, omdat het afhangt van hoe kristallijn of glasachtig het is. De zuiver kristallijne vorm smelt bij 450 ° C; de glasachtige vorm smelt echter in een bereik van temperaturen van 300 tot 700 ° C.
Kookpunt
Nogmaals, de gerapporteerde waarden komen niet overeen met deze waarde. Blijkbaar kookt vloeibaar boriumoxide (gesmolten uit de kristallen of het glas) bij 1860 ºC.
stabiliteit
Het moet droog worden gehouden, omdat het vocht absorbeert en verandert in boorzuur, B (OH)3.
nomenclatuur
Boriumoxide kan op andere manieren worden genoemd, zoals:
-Diboro trioxide (systematische nomenclatuur).
-Boriumoxide (III) (voorraadbenaming).
-Boorzuur (traditionele nomenclatuur).
toepassingen
Enkele toepassingen van booroxide zijn:
Synthese van boortrihalogeniden
Van B2O3 kunnen gesynthetiseerde trihalogeniden, BX, zijn3 (X = F, Cl en Br). Deze verbindingen zijn Lewis-zuren, en met hen is het mogelijk boriumatomen aan bepaalde moleculen toe te voegen om andere derivaten met nieuwe eigenschappen te verkrijgen.
insecticide
Een vast mengsel met boorzuur, B2O3-B (OH)3, vertegenwoordigt een formule die wordt gebruikt als een huishoudelijk insecticide.
Oplosmiddel van metaaloxiden: vorming van glas, keramiek en boorlegeringen
Vloeibaar booroxide is in staat metaaloxiden op te lossen. Uit dit resulterende mengsel worden, eenmaal afgekoeld, vaste stoffen verkregen door boor en metalen.
Afhankelijk van de hoeveelheid B2O3 gebruikt, evenals de techniek en het type metaaloxide, kunt u een rijke verscheidenheid aan brillen (borosilicaten), keramiek (nitriden en boorcarbiden) en legeringen (als alleen metalen worden gebruikt) krijgen.
In het algemeen krijgen glas of keramiek meer sterkte en sterkte, evenals een grotere duurzaamheid. In het geval van een bril worden ze uiteindelijk gebruikt voor optische lenzen en telescopen, en voor elektronische apparaten.
binder
Bij de constructie van ovens voor het smelten van staal worden vuurvaste stenen met magnesiumbasis gebruikt. Daarin wordt boriumoxide als bindmiddel gebruikt, waardoor ze stevig gebonden blijven.
referenties
- Shiver & Atkins. (2008). Anorganische chemie (Vierde editie). Mc Graw Hill.
- Wikipedia. (2019). Boortrioxide. Teruggeplaatst van: en.wikipedia.org
- PubChem. (2019). Boorzuur oxide. Teruggeplaatst van: pubchem.ncbi.nlm.nih.gov
- Rio Tinto. (2019). Borix oxide. 20 Mule Team Borax. Teruggeplaatst van: borax.com
- A. Mukhanov, O. O. Kurakevich en V. L. Solozhenko. (N.D.). Over de hardheid van borium (III) oxide. LPMTMCNRS, Université Paris Nord, Villetaneuse, Frankrijk.
- Hansen T. (2015). B2O3 (Boric Oxide). Teruggeplaatst van: digitalfire.com


