Goudoxide (III) (Au2O3) structuur, eigenschappen, nomenclatuur en toepassingen
de goudoxide (III) is een anorganische stof waarvan de chemische formule Au is2O3. Theoretisch zou je kunnen verwachten dat de aard ervan van het covalente type is. De aanwezigheid van een bepaald ionisch karakter in de vaste stof kan echter niet geheel worden weggegooid; of wat hetzelfde is, veronderstel de afwezigheid van de Au kation3+ naast de anion O2-.
Het lijkt misschien tegenstrijdig dat goud, als een edel metaal, kan roesten. Onder normale omstandigheden kunnen stukjes goud (zoals de sterren in de afbeelding hieronder) niet worden geoxideerd door contact met zuurstof in de atmosfeer; wanneer het echter wordt bestraald met ultraviolette straling in aanwezigheid van ozon, OF3, de foto is anders.

Als de gouden sterren aan deze voorwaarden werden onderworpen, zouden ze een roodachtig bruin worden, kenmerkend voor de Au2O3.
Andere methoden om dit oxide te verkrijgen, zijn de chemische behandeling van de sterren; bijvoorbeeld, het omzetten van de goudmassa in zijn respectieve chloride, AuCl3.
Na, naar de AuCl3, en de rest van de mogelijke goudzouten gevormd, een sterk basismedium is toegevoegd; en hiermee krijg je het gehydrateerde oxide of hydroxide, Au (OH)3. Uiteindelijk wordt deze laatste verbinding thermisch gedehydrateerd om de Au te verkrijgen2O3.
index
- 1 Structuur van goudoxide (III)
- 1.1 Elektronische aspecten
- 1.2 Hydraten
- 2 Eigenschappen
- 2.1 Fysiek uiterlijk
- 2.2 Molecuulmassa
- 2.3 Dichtheid
- 2,4 Smeltpunt
- 2.5 Stabiliteit
- 2.6 Oplosbaarheid
- 3 Nomenclatuur
- 4 Gebruik
- 4.1 Kleur van een bril
- 4.2 Synthese van auraten en fulminerend goud
- 4.3 Behandeling van zelf-geassembleerde monolagen
- 5 Referenties
Structuur van goudoxide (III)
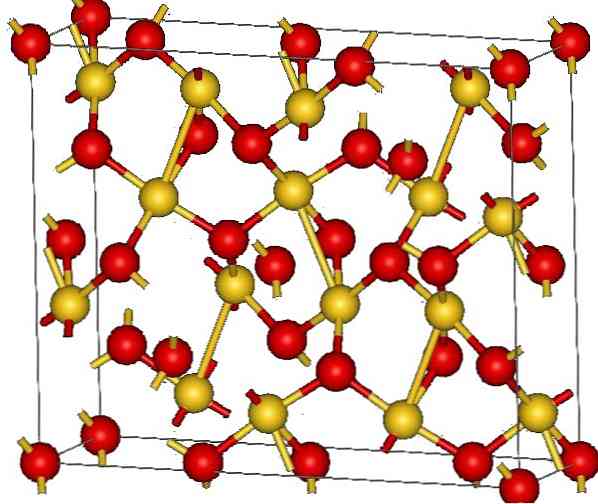
De kristalstructuur van goud (III) oxide wordt getoond in het bovenste beeld. De rangschikking van de goud- en zuurstofatomen in de vaste stof wordt weergegeven, hetzij als neutrale atomen (covalente vaste stof), hetzij als ionen (ionische vaste stof). Onduidelijk, het is voldoende om de Au-O-koppelingen in elk geval te elimineren of te plaatsen.
Volgens het beeld wordt aangenomen dat het covalente karakter overheerst (wat logisch zou zijn). Om die reden worden de weergegeven atomen en bindingen weergegeven met respectievelijk bollen en staven. De gouden bollen komen overeen met de goudatomen (AuIII-O), en roodachtig tot zuurstofatomen.
Als je goed kijkt, zie je dat er AuO-eenheden zijn4, die verbonden zijn door zuurstofatomen. Een andere manier om het te visualiseren is om te overwegen dat elke Au3+ is omringd door vier O2-; Natuurlijk, vanuit een ionisch perspectief.
Deze structuur is kristallijn omdat de atomen zijn geordend volgens hetzelfde patroon met lange afstanden. De eenheidscel komt dus overeen met het rhomboëdrische kristallijne systeem (hetzelfde als in het bovenste beeld). Daarom is alle Au2O3 kan worden gebouwd als al die sferen van de eenheidscel in de ruimte zijn verdeeld.
Elektronische aspecten
Goud is een overgangsmetaal en het is te verwachten dat zijn 5d orbitalen direct interageren met de 2p-orbitalen van het zuurstofatoom. Deze overlapping van hun orbitalen zou theoretisch geleidingsbanden moeten genereren, die de Au zouden kunnen omvormen2O3 in een vaste halfgeleider.
Daarom is de ware structuur van de Au2O3 is nog complexer met dit in gedachten.
hydrateert
Goudoxide kan watermoleculen in de rhomboëdrische kristallen vasthouden, wat aanleiding geeft tot hydraten. Wanneer dergelijke hydraten worden gevormd, wordt de structuur amorf, dat wil zeggen, verstoord.
De chemische formule voor dergelijke hydraten kan een van de volgende zijn, die in feite niet diep zijn opgehelderd: Au2O3∙ zH2O (z = 1, 2, 3, etc.), Au (OH)3, of AuXOen(OH)z.
De formule Au (OH)3 vertegenwoordigt een te grote vereenvoudiging van de ware samenstelling van genoemde hydraten. Dit komt omdat binnen het goudhydroxide (III) onderzoekers ook de aanwezigheid van Au hebben gevonden2O3; en daarom is het zinvol om het geïsoleerd te behandelen als een "eenvoudig" overgangsmetaalhydroxide.
Aan de andere kant, van een vaste stof met formule AuXOen(OH)z een amorfe structuur kan worden verwacht; omdat dit afhangt van de coëfficiënten X, en en z, waarvan de variaties zouden leiden tot allerlei structuren die nauwelijks een kristallijn patroon zouden kunnen vertonen.
eigenschappen
Uiterlijke verschijning
Het is een roodachtig bruine vaste stof.
Moleculaire massa
441,93 g / mol.
dichtheid
11,34 g / ml.
Smeltpunt
Het smelt en ontleedt bij 160ºC. Het mist dus kookpunt, dus dit oxide bereikt nooit het kookpunt.
stabiliteit
De Au2O3 het is thermodynamisch onstabiel, omdat goud, zoals vermeld aan het begin, niet neigt te oxideren onder normale temperatuuromstandigheden. Dus het wordt gemakkelijk gereduceerd om opnieuw het edele goud te worden.
Hoe hoger de temperatuur, hoe sneller de reactie, die bekend staat als thermische ontleding. Dus de Au2O3 bij 160 ° C ontbindt het om metaalachtig goud te produceren en moleculaire zuurstof vrij te maken:
2 Au2O3 => 4 Au + 3 O2
Een zeer vergelijkbare reactie kan optreden met andere verbindingen die genoemde reductie bevorderen. Waarom reductie? Omdat het goud terugkeert om de elektronen te krijgen die zuurstof ervan heeft weggenomen; wat hetzelfde is als te zeggen dat het verbindingen met zuurstof verliest.
oplosbaarheid
Het is een vaste stof die onoplosbaar is in water. Het is echter oplosbaar in zoutzuur en salpeterzuur, vanwege de vorming van goudchlorides en nitraten.
nomenclatuur
Goudoxide (III) is de naam die wordt bepaald door de voorraadnomenclatuur. Andere manieren om het te noemen zijn:
-Traditionele nomenclatuur: aureric oxide, omdat de valentie 3+ het hoogste is voor goud.
-Systematische nomenclatuur: dioro-trioxide.
toepassingen
Kleuren van glazen
Een van de meest eminente toepassingen is het leveren van roodachtige kleuren aan bepaalde materialen, zoals een bril, naast het verlenen van bepaalde eigenschappen die inherent zijn aan de goudatomen..
Synthese van auraten en fulminerend goud
Als de Au is toegevoegd2O3 tot een medium waarin het oplosbaar is, en in aanwezigheid van metalen, kunnen de auraten precipiteren na de toevoeging van een sterke base; welke, worden gevormd door AuO-anionen4- in het gezelschap van metaalkationen.
Ook de Au2O3 reageert met ammoniak om de goud-fulminerende verbinding te vormen, Au2O3(NH3)4. De naam is afgeleid van het feit dat het zeer explosief is.
Behandeling van zelf-geassembleerde monolagen
Op goud en zijn oxide worden bepaalde verbindingen, zoals dialkyldisulfiden, RSSR, niet op dezelfde manier geadsorbeerd. Wanneer deze adsorptie optreedt, wordt een Au-S-binding spontaan gevormd, waarbij het zwavelatoom de chemische eigenschappen van het oppervlak vertoont en definieert afhankelijk van de functionele groep waaraan het is gebonden..
De RSSR kan niet adsorberen op de Au2O3, maar op metallic goud. Daarom, als het oppervlak van het goud en de mate van oxidatie worden gewijzigd, evenals de grootte van de deeltjes of lagen van Au2O3, een meer heterogeen oppervlak kan worden ontworpen.
Deze oppervlakte Au2O3-AuSR interageert met de metaaloxiden van bepaalde elektronische apparaten, waardoor toekomstige slimmere oppervlakken worden ontwikkeld.
referenties
- Wikipedia. (2018). Goud (III) oxide. Teruggeplaatst van: en.wikipedia.org
- Chemische formulering (2018). Goudoxide (III). Hersteld van: formulacionquimica.com
- D. Michaud. (24 oktober 2016). Goudoxiden. 911 Metallurg. Teruggeplaatst van: 911metallurgist.com
- Shi, R. Asahi en C. Stampfl. (2007). Eigenschappen van de goudoxiden Au2O3 en Au2O: onderzoek naar de eerste beginselen. De American Physical Society.
- Cook, Kevin M. (2013). Goudoxide als maskerende laag voor regioselectieve oppervlaktescheikunde. Scripties en proefschriften. Papier 1460.


