Acinetobacter baumannii kenmerken, morfologie, metabolisme
Acinetobacter baumannii Het is een gram-negatieve bacterie, die tot de orde van pseudomonas behoort. Doorheen zijn taxonomische geschiedenis is het in de geslachten gesitueerd Micrococcus, Moraxella, Alcaligenes, Mirococcuscalco-aceticus, Herellea en Achromobacter, tot het zich in 1968 in zijn huidige genre bevond.
Een. baumannii Het is een pathogene bacterie, beschouwd als de soort die het meest frequent is betrokken bij infecties binnen zijn geslacht. Ze is betrokken bij verschillende soorten infecties, zoals bloedvergiftiging, longontsteking en meningitis..
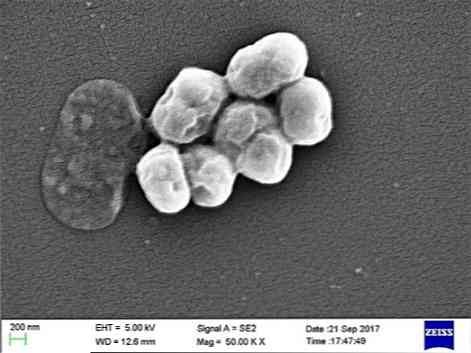
Het is een opportunistische parasiet die een belangrijke incidentie heeft in ziekenhuis- of nosocomiale ziekten. Transmissie door mechanische ventilatie is geïndiceerd als een belangrijke oorzaak van infectie, vooral in intensive care-eenheden.
Ondanks dat het wordt beschouwd als een laaggradig pathogeen, heeft het het vermogen om de virulentie ervan te verhogen in stammen die zijn betrokken bij frequente infecties. Het heeft een groot vermogen om resistentie en multiresistentie tegen antibiotica te ontwikkelen.
In ziekenhuizen wordt het voornamelijk overgedragen door het contact van het personeel, door het gebruik van vervuilde ziekenhuismaterialen en ook door de lucht over korte afstanden..
De Wereldgezondheidsorganisatie omvat A. baumannii in een lijst van resistente pathogenen waarvoor nieuwe antibiotica dringend vereist zijn, waarbij categorie 1 wordt toegewezen, met kritieke prioriteit.
index
- 1 Biologische kenmerken
- 2 Morfologie
- 3 Metabolisme
- 4 Weerstand tegen antibiotica
- 5 Pathologieën
- 6 symptomen
- 7 Behandeling
- 8 Referenties
Biologische eigenschappen
Alle soorten van het geslacht Acinetobacter ze hebben een brede verspreiding in verschillende natuurlijke niches. A. baumannii het kan van nature de huid van gezonde mensen bewonen, in staat zijn om de slijmvliezen te koloniseren, wat een belangrijk epidemiologisch reservoir vormt. Echter, de habitat van A. baumannii het is bijna exclusief voor ziekenhuisomgevingen.
Deze bacteriën missen flagella of structuren die worden gebruikt voor vervoer. De beweging bereikt structuren waarmee ze in- en uitschuiven en chemische mechanismen zoals uitscheiding van een film van een hoogmoleculair exopolysaccharide molecuulgewicht achter de bacterie.
A. baumannii kan een groot aantal levende of inerte omgevingen koloniseren en heeft een groot vermogen om te overleven op kunstmatige oppervlakken gedurende een langere periode.
Deze capaciteit is mogelijk te wijten aan het vermogen ervan om uitdroging te weerstaan, om verschillende koolstofbronnen te gebruiken via verschillende metabole routes en de mogelijkheid om biofilms te vormen. Om deze reden is het gebruikelijk om het in ziekenhuisapparatuur te vinden, zoals katheters en mechanische beademingsapparatuur.
morfologie
A. baumannii is een coccobacillus, tussenvorm tussen kokosnoten en stokken. Ze meten 1,5 tot 2,5 bij 1 tot 1,5 micron wanneer de populaties zich in een logaritmische groeifase bevinden. Ze zijn meer bolvormig wanneer ze de stationaire fase bereiken.
metabolisme
De bacterie A. baumannii het is geen fermentor van glucose; het is strikt aëroob, dat wil zeggen dat het zuurstof nodig heeft voor zijn metabolisme.
De soort van het geslacht Acinetobacter zij zijn de enigen van de familie Moraxellaceae die cytochrome c-oxidasen missen, waarvoor ze negatieve resultaten geven in de oxidasetests.
A. baumannii het groeit bij temperaturen die variëren tussen 20 en 44ºC, met een optimale temperatuur tussen 30 en 35ºC.
Weerstand tegen antibiotica
De constante generatie van resistentie tegen antibiotica belemmert niet alleen de behandeling en bestrijding van infecties die door A. baumannii, het bevordert ook de selectie van endemische en epidemische multiresistente stammen.
Enkele intrinsieke mechanismen van A. baumannii, die antibioticaresistentie bevorderen:
- De aanwezigheid van β-lactamasen verleent resistentie tegen b-lactams.
- De productie van specifieke enzymen zoals ammoniglucoside-3'-fosfotransferase VI inactiveert amikacine.
- De aanwezigheid van oxacillinase OXA-51 hydrolyseert penicillines en carbapenems.
- De aanwezigheid en overexpressie van refluxpompen, dit zijn pompen die kleine moleculen buiten de cel uitstoten die in het cytoplasma doordringen, waardoor hun gevoeligheid voor antibiotica afneemt.
De biofilms gegenereerd door A. baumannii ze veranderen het metabolisme van micro-organismen, verminderen hun gevoeligheid voor antibiotica, bieden een fysieke barrière tegen grote moleculen en voorkomen de uitdroging van bacteriën.
pathologieën
A. baumannii koloniseert een nieuwe gastheer door contact te maken met besmette mensen of met besmette medische apparatuur. Ten eerste hecht deze bacterie zich aan de huid en slijmvliesoppervlakken. Om te reproduceren, moet het antibioticum en remmende middelen en de omstandigheden van deze oppervlakken overleven.
De toename van het aantal bacteriën op slijmvliesoppervlakken, met name bij ziekenhuisopname in contact met intravasculaire katheters of endotracheale buizen, kan het risico op infectie van de luchtwegen en de bloedbaan bevorderen..
Longontsteking gecontracteerd in ziekenhuizen is de meest voorkomende van de infecties geproduceerd door A. baumanii. Vaak gecontracteerd in de intensive care-eenheden, door patiënten die mechanisch geassisteerde ademhaling ontvangen.
A. baumanii Het heeft ook grote problemen veroorzaakt door infecties bij militair personeel met naoorlogse trauma's, met name in Irak en Afghanistan. Specifiek vanwege osteomyelitis en weke delen infecties, die necrose en cellulitis kunnen veroorzaken.
Er zijn ook risico's op meningitis A. baumanii bij patiënten die herstellen van neurochirurgies.
Individuen vatbaar voor infectie door A. baumanii omvatten die welke eerder zijn onderworpen aan het gebruik van antibiotica, grote operaties, brandwonden, trauma, immunosuppressie of het gebruik van invasieve medische hulpmiddelen, voornamelijk mechanische ventilatie, in Intensive Care Units.
symptomen
Er is geen specifieke symptomatologie van infecties veroorzaakt door A. baumanii. Elk van de verschillende infecties die door deze bacterie worden geproduceerd, heeft zijn eigen kenmerkende symptomen.
Over het algemeen de symptomen van infecties die kunnen optreden A. baumanii of andere opportunistische bacteriën zoals Klebsiella pneumoniae en Streptococcus pneumoniae, kan koorts, koude rillingen, uitslag, pijnlijk urineren, dringende noodzaak om vaak te plassen, verwarring of veranderde mentale toestanden, misselijkheid, spierpijn, pijn op de borst en hoesten te omvatten.
behandeling
Antibiotica om infecties te behandelen A. baumannii ze zijn extreem beperkt vanwege hun grote capaciteit om weerstanden en multiresistentie te verwerven. Daarom is het belangrijk om de gevoeligheid van elke stam voor verschillende antibiotica te bepalen om de effectiviteit van elke behandeling te garanderen.
Met het oog op de resistentie tegen carbapenems is het gebruik van polymyxinen, met name colistine, gebruikt, ondanks dat het een relatief lage resistentie-index heeft en de neveneffecten ervan op de nieren..
Er zijn echter reeds stammen die resistent zijn tegen colistine gedetecteerd. Als alternatief voor resistentie tegen deze antibiotica is combinatietherapie gebruikt.
referenties
- Bergogne-Bérézin, E. & Towner, K.J.. Acinetobacter spp. als nosocomiale pathogenen: microbiologische, klinische en epidemiologische kenmerken. Clin Microbiol Rev, 9 (1996), pp. 148-165.
- Fournier, P.E., Richet, H. (2006). De epidemiologie en controle van Acinetobacter baumanii in voorzieningen voor gezondheidszorg. Clinical Infectious Diseases, 42: 692-9.
- Hernández Torres, A., García Vázquez, E., Yagüe, G. &, Gómez Gómez, J. (2010) Acinetobacter baumanii multiresistent: huidige klinische situatie en nieuwe perspectieven Spanish Journal of Chemotherapy, 23 (1): 12-19.
- Maragakis LL, Perl TM. Acinetobacter baumanii: Epidemiologie, Antimicrobiële resistentie en behandelingsmogelijkheden. Clin Infec Dis 2008; 46: 1254-63.
- McConnell, M.j., Actis, L. & Pachón, J. (2013) Acinetobacter baumannii: menselijke infecties, factoren die bijdragen aan pathogenese en diermodellen. FEMS Microbiology Reviews, 37: 130-155.
- Peleg, A.Y., Seifert, H. & Paterson, D.L. (2008). Acinetobacter baumannii: opkomst van een succesvolle ziekteverwekker. Clinical Microbiology Reviews, 21 (3): 538-82.
- Vanegas-Múnera, J.M., Roncancio-Villamil, G. & Jiménez-Quiceno, J.N. (2014). Acinetobacter baumannii: klinisch belang, resistentiemechanismen en diagnose. CES Medicine Journal, 28 (2): 233-246.


