Giemsa kleuring fundering, materialen, techniek en toepassingen
de Giemsa vlek is een soort kleuring van klinische monsters, gebaseerd op het mengsel van zure en basische kleurstoffen. De creatie ervan werd geïnspireerd door het werk van Romanowsky, waar Gustav Giemsa, een Duitse chemicus en bacterioloog, het perfectioneerde door glycerol toe te voegen om de verbindingen te stabiliseren.
De veranderingen die zijn gegenereerd met de originele techniek van Romanowsky hebben de microscopische waarnemingen aanzienlijk kunnen verbeteren, daarom werd de techniek gedoopt met de naam Giemsa-kleuring.
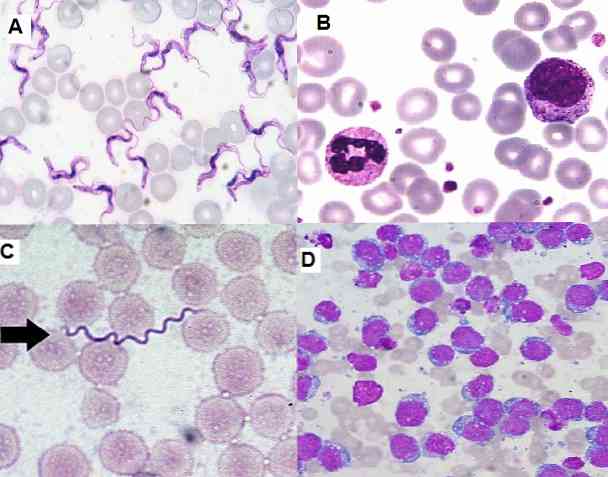
Omdat het een eenvoudige techniek is om uit te voeren, zeer functioneel en economisch, wordt het momenteel veel gebruikt in het klinische laboratorium voor hematologische uitstrijkjes, beenmergmonsters en weefselcoupes..
De Giemsa kleuringstechniek is zeer nuttig voor cytologische studies, omdat het de observatie van specifieke structuren van cellen mogelijk maakt. Deze techniek kleurt de cytoplasma's, kernen, nucleoli, vacuolen en korrels van de cellen, in staat om zelfs fijne sporen van chromatine te onderscheiden.
Bovendien kunnen significante veranderingen in de grootte, vorm of kleuring van de kern worden gedetecteerd, waar het mogelijk is om het verlies van de nucleus-cytoplasma-relatie te visualiseren.
Aan de andere kant maakt het het mogelijk onrijpe cellen in beenmerg en perifeer bloed te identificeren, wat belangrijk is voor de diagnose van ernstige ziekten zoals leukemie. Het is ook mogelijk om hemoparasieten, extra en intracellulaire bacteriën, schimmels, onder anderen te detecteren.
In cytogenetica wordt het vrij gebruikt, omdat het mogelijk is om de mitose van cellen te bestuderen.
index
- 1 Fundering van de Giemsa-kleuring
- 2 materialen
- 2.1 Materialen voor de bereiding van de moederoplossing
- 2.2 Voorbereidingsmodus van de moederoplossing
- 2.3 Materialen om de bufferoplossing te bereiden
- 2.4 Laatste bereiding van de kleurstof
- 2.5 Extra materialen die nodig zijn om de kleuring uit te voeren
- 3 Techniek
- 3.1 Kleuringsproces
- 4 hulpprogramma's
- 4.1 Hematologie
- 4.2 Mycologie
- 4.3 Bacteriologie
- 4.4 Parasitologie
- 4.5 Cytologie
- 4.6 Cytogenetica
- 5 Onderzoek dat de effectiviteit van Giemsa-kleuring aantoont
- 6 Aanbevelingen voor een goede kleuring
- 7 Veelgemaakte fouten in de inkleuring van Giemsa
- 7.1 Extreem blauwe verkleuring
- 7.2 Overmatig roze verkleuring
- 7.3 Aanwezigheid van neerslagen in het uitstrijkje
- 7.4 Aanwezigheid van morfologische artefacten
- 8 Opslagmodus
- 9 Referenties
Fundering van de Giemsa kleuring
De Romanowsky-type kleurstoffen zijn gebaseerd op het gebruik van een contrast tussen zuur en basische kleurstoffen om kleuring van respectievelijk de basische en zuurstructuren te bereiken. Zoals te zien is er een affiniteit van de zure kleurstoffen om de basisstructuren te verven en omgekeerd.
De basische kleurstof die wordt gebruikt, is methyleenblauw en de geoxideerde derivaten ervan (Azure A en Azure B), terwijl de zure kleurstof eosine is.
De zuurstructuren van de cellen zijn de nucleïnezuren, de korrels van de gesegmenteerde basofielen, en daarom zullen ze worden geverfd met methyleenblauw.
In dezelfde zin zijn de basisstructuren van de cellen hemoglobine en enkele korrels, zoals die in de gesegmenteerde eosinofielen, onder andere; deze worden geverfd met eosine.
Aan de andere kant kunnen, vanwege het feit dat methyleenblauw en azuur worden gekenmerkt door metachromatische kleurstoffen, ze een variabele tint aan de verschillende structuren verschaffen in overeenstemming met de lading polyanionen die zij bezitten..
Dus de strategische combinatie van zure en basische kleurstoffen kunnen een breed spectrum van kleuren te ontwikkelen, volgens de biochemische eigenschappen van elke structuur, stimulatie lichtblauw donkerblauw tinten, paars en paars bij de zure structuren.
Terwijl de kleuring door eosine stabieler is, genereert het kleuren tussen roodachtig oranje en zalm.
materialen
Materialen voor de bereiding van de moederoplossing
Voor de bereiding van de stamoplossing is een weging van 600 mg poedervormige Giemsa-kleurstof vereist, waarbij 500 cc acetonvrije methylalcohol en 50 cc neutrale glycerine worden gemeten.
Voorbereidingsmodus van de moederoplossing
Plaats het zware Giemsa-poeder in een vijzel. Als er klontjes zijn, moeten deze worden bespoten. Voeg vervolgens een aanzienlijke hoeveelheid van de gemeten glycerine toe en meng goed. Het verkregen mengsel wordt in een zeer schone amberkleurige fles gegoten.
De rest van de glycerine wordt in de mortel geplaatst. Meng opnieuw om de resterende kleurstof te reinigen die aan de wanden van de mortel is geplakt en in dezelfde fles giet.
De fles is bedekt en wordt gedurende 2 uur in een waterbad bij 55 ° C gedragen. Terwijl u in een bain-marie-bad bent, roer het mengsel elk half uur of zo lichtjes om.
Vervolgens laat men het mengsel afkoelen om de alcohol te plaatsen. Eerder werd een deel van de gemeten alcohol in de mortel geplaatst om het resterende deel van de kleurstof af te wassen en vervolgens werd het samen met de rest van de alcohol aan het mengsel toegevoegd.
Deze voorbereiding moet worden toegestaan om te rijpen gedurende ten minste 2 weken. Het gedeelte dat wordt gebruikt voor de moederoplossing moet worden gefilterd.
Om contaminatie van het preparaat te voorkomen, wordt het aangeraden om het gedeelte dat constant in gebruik is door te geven aan een kleine barnsteenfles met druppelaar. Herlaad elke keer dat het reagens op is.
Materialen om de bufferoplossing te bereiden
Aan de andere kant wordt een bufferoplossing bij pH 7,2 als volgt bereid:
6,77 gram natriumfosfaat (watervrij) wordt gewogen (NaHPO4), 2,59 g kaliumdiwaterstoffosfaat (KH)2PO4) en gedestilleerd water tot 1000 cc.
Laatste voorbereiding van de kleurstof
Voor de bereiding van de uiteindelijke kleuroplossing wordt 2 cm3 van de gefiltreerde voorraadoplossing gemeten en gemengd met 6 cm3 bufferoplossing. Het mengsel wordt geroerd.
Een relevant feit waarmee rekening moet worden gehouden, is dat de technieken voor de bereiding van de kleurstof kunnen veranderen naargelang van het commerciële huis.
Extra materialen die nodig zijn om de kleuring uit te voeren
Naast de beschreven materialen, moet bruggen kleuren pisetas met water of buffer voor het wassen, neusstuk of dekglaasje vellen, een timer om de tijd te kleuren en vloeipapier of materiaal dat dient te drogen controleren ( gaas of katoen).
techniek
Kleuringproces
1) Voordat u gaat kleuren, moet u het monster verspreiden op een schone dia..
De monsters kunnen bloed, beenmerg, delen van histologisch weefsel of cervico-vaginale monsters zijn. Het wordt aanbevolen dat de buitenkant dun is en 1 of 2 uur droogt voordat u ze inkleurt.
2) Alle vellen die u moet kleuren worden op een gekleurde brug geplaatst. Werk altijd in dezelfde volgorde en identificeer elk vel goed.
3) Plaats een paar druppels 100% methylalcohol (methanol) op het uitstrijkje en laat gedurende 3 tot 5 minuten staan om het monster te fixeren en te dehydrateren.
4) Gooi de in het folie aanwezige methanol weg en laat aan de lucht drogen.
5) Plaats na het drogen de laatste kleuroplossing met een druppelaar totdat het hele vel is bedekt. Laat het 15 minuten staan. Sommige auteurs raden tot 25 minuten aan. Afhankelijk van het commerciële huis.
6) Tap de kleurstof af en was het uitstrijkje met gedestilleerd water of met een 7.2-bufferoplossing.
7) Laat de vellen op een vloeipapier in de open lucht drogen, verticaal gerangschikt met behulp van een steun.
8) Veeg de achterkant van de dia af met een gaasje of wattenstaafje bevochtigd met alcohol om eventuele resterende verfresten te verwijderen.
nutsbedrijven
De Giemsa-kleuringstechniek wordt op verschillende gebieden gebruikt, waaronder: hematologie, mycologie, bacteriologie, parasitologie, cytologie en cytogenetica.
hematologie
Het is het meest voorkomende hulpmiddel dat aan deze kleuring wordt gegeven. Hiermee kunnen we elk van de cellen identificeren die aanwezig zijn in monsters van beenmerg of perifeer bloed. Evenals het schatten van het aantal van elke reeks, het kunnen detecteren van leukocytose of leukopenie, trombocytopenie, etc..
Omdat het gevoelig is voor het identificeren van onrijpe cellen, is het relevant bij de diagnose van acute of chronische leukemieën. Het is ook mogelijk om anemie, zoals sikkelcelanemie, sikkelcelanemie, te diagnosticeren..
mycologie
In dit gebied is het gebruikelijk om ernaar te zoeken Histoplasma capsulatum (intracellulaire dimorfe schimmel) in weefselmonsters.
bacteriologie
In hematologische uitstrijkjes gekleurd met Giemsa is het mogelijk om te detecteren Borrelias sp bij patiënten met de ziekte koorts recurrentis. Spirocheten komen voor bij erytrocyten, in monsters genomen op de koortspiek.
Het is ook mogelijk om intracellulaire bacteriën te visualiseren als: Rickettsias sp en Chlamydia trachomatis in geïnfecteerde cellen.
parasitologie
Op het gebied van de parasitologie heeft Giemsa-kleuring de diagnose van parasitaire ziekten zoals malaria, de ziekte van Chagas en leishmaniasis mogelijk gemaakt..
In de eerste twee de parasieten Plasmodium sp en de Trypanosoma cruzi respectievelijk kunnen ze worden gevisualiseerd in perifeer bloed van de geïnfecteerde patiënten, ze kunnen worden gevonden in verschillende stadia volgens de fase waarin de ziekte is.
Om de zoektocht naar bloedparasieten te verbeteren, wordt het aanbevolen om Giemsa-kleurstof gemengd met de May-Grünwald-kleurstof te gebruiken.
Evenzo kan cutane leishmaniasis worden vastgesteld bij het evalueren van monsters van huidbiopten gekleurd met Giemsa, waar de parasiet wordt gevonden.
cytology
Giemsa-kleuring wordt ook gebruikt voor de cytologische studie van endocervicale monsters, hoewel het niet de meest gebruikte techniek voor dit doel is.
Maar in gevallen van schaarste aan middelen kunnen worden gebruikt, met een functionaliteit vergelijkbaar met die aangeboden door de Papanicolaou-techniek en tegen lagere kosten. Het vereist echter expertise van de kant van de examinator.
cytogenetica
Een relevant kenmerk van Giemsa-kleuring is het vermogen ervan om sterk te binden aan gebieden die rijk zijn aan DNA-adeninen en thyminen. Hierdoor kan het DNA worden gevisualiseerd tijdens de mitose van de cellen, in verschillende condensatietoestanden.
Deze studies zijn nodig om chromatische aberraties zoals duplicaties, deleties of translocaties van de verschillende gebieden van de chromosomen te detecteren..
Onderzoek dat de werkzaamheid van Giemsa-kleuring aantoont
Cannova et al (2016) vergeleken 3 kleurtechnieken voor de diagnose van cutane leishmaniasis.
Hiervoor gebruikten ze monsters verkregen van een proefdier (Mesocrisetus auratus) experimenteel geïnoculeerd met Leishmanias.
De auteurs toonden aan dat Giemsa-kleuring beter was dan Pap-mart® en Gaffney-kleuring. Daarom vonden ze dat de Giemsa-kleuring ideaal is om cutane leishmaniasis te diagnosticeren.
De uitstekende resultaten verkregen door de auteurs zijn te wijten aan de combinatie van kleurstoffen die deel uitmaken van het mengsel van Giemsa presenteert de nodige maatregelen om een gunstig contrast voorwaarden scheppen, zodat duidelijk onderscheid structuren amastigoten zowel intra- als extracellulair.
De andere technieken (Pap-mart® en Gaffney) deden het ook, maar op een zwakkere manier en daarom moeilijker te visualiseren. Dat is de reden waarom de Giemsa-kleuring wordt aanbevolen voor de parasitologische diagnose van leishmaniasis.
Evenzo evalueerde een onderzoek door Ramírez et al (1994) de validiteit van Giemsa en Lendrum-vlekken in conjunctivale uitstrijkjes voor de identificatie van Chlamydia trachomatis.
De auteurs stelden vast dat Giemsa en Ledrum-kleuring dezelfde specificiteit hebben, maar Giemsa was gevoeliger.
Dit verklaart waarom Giemsa-kleuring momenteel het meest wordt gebruikt voor de diagnose van chlamydiale infecties, vooral als er weinig middelen zijn.
Aanbevelingen voor een goede kleuring
Het drogen van de vellen mag niet worden versneld. De prudentiële tijd moet worden gewacht voor het drogen in de open lucht. Ongeveer 2 uur.
Kleur onmiddellijk na 2 uur voor het beste resultaat.
Om de uitstrijkjes beter te fixeren en te kleuren, moet het monster zodanig op het blad worden verdeeld dat er een dunne en uniforme laag achterblijft.
Het geprefereerde bloedmonster is het capillair, omdat het uitstrijkje direct uit de bloeddruppel wordt gemaakt en daarom heeft het monster geen additief, wat gunstig is voor het onderhoud van celstructuren..
Als echter veneus bloed wordt gebruikt, moet EDTA worden gebruikt als een anticoagulans en niet als heparine, omdat laatstgenoemden de cellen meestal vervormen.
Veelgemaakte fouten in de inkleuring van Giemsa
In de praktijk van deze kleuring kunnen fouten worden gemaakt. Ze worden geïllustreerd door plotselinge veranderingen in de schakeringen van de structuren.
Extreem blauwe kleur
Het kan te wijten zijn aan:
- Zeer dikke uitstrijkjes
- De kleuringstijd overschrijden
- Te weinig was.
- Gebruik van reagentia ruim boven neutrale pH (alkalisch).
Onder deze omstandigheden de kleuren van de volgende structuren worden vervormd, zodat erytrocyten in plaats van roze geverfd-zalm groen zal zijn, zal de korrels van eosinofielen die moeten worden gekleurd rode baksteen blauw of grijs draaien en zo verder wil afwijking in de gebruikelijke kleuren.
Overmatig roze verkleuring
Het kan te wijten zijn aan:
- Onvoldoende kleuringstijd.
- Langdurig of overmatig wassen.
- Slecht drogen.
- Gebruik van zeer zure reagentia.
In dit specifieke geval zullen de structuren die normaal blauw gekleurd zijn, niet bijna zichtbaar zijn, terwijl de structuren die roze gekleurd zijn zeer overdreven tonaliteit hebben.
Voorbeeld: erytrocyten neem een krachtige, heldere rode of oranje kleur, zal de nucleaire chromatine lichtroze en korrels van eosinofielen zijn gekleurd helder rood intense.
Aanwezigheid van neerslagen in het uitstrijkje
De oorzaken kunnen zijn:
- Gebruik vuile of slecht gewassen vellen.
- Laat het uitstrijkje niet goed drogen.
- Laat de fixeeroplossing te lang liggen.
- Onvoldoende wassen aan het einde van de kleuring.
- Ontoereikende filtratie of niet-filtratie van de kleurstof die wordt gebruikt.
Aanwezigheid van morfologische artefacten
Morfologische artefacten kunnen in de uitstrijkjes verschijnen, waardoor het moeilijk wordt de aanwezige structuren te visualiseren en te interpreteren. Dit komt door:
- Type antistollingsmiddel dat wordt gebruikt, zoals heparine.
- Gebruik van vuile, beschadigde of vette vellen.
Opslagmodus
Na de bereiding moet de kleurstof op kamertemperatuur (15 - 25 ° C) worden bewaard om te voorkomen dat de kleurstof neerslaat. Het moet worden bewaard in een gesloten oranje houder.
referenties
- Cannova D, Brito E en Simons M. Evaluatie van kleuringstechnieken voor de diagnose van cutane Leishmaniasis. Salus. 2016; 20 (2): 24-29.
- PanReac Applichem ITW-reagentia. Giemsa vlek. Versie 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Spanje.
- Clark G.-kleuringsprocedures (1981), 4e eeuw. Williams & Willkins.
- Toegepaste klinische chemie Giemsa kleurstof voor diagnose in vitro. Distributeur: cromakit.es
- Ramirez R, Mejia M, Garcia de la Riva J, F en Hermes Grazioso C. Geldigheid Giemsa en Lendrum in conjunctivale doekjes voor het identificeren Chlamydia trachomatis. Bol of Sanit Panam. 1994; 116 (3): 212-216.
- Casas-Rincon G. Algemene mycologie. 1994. 2de uitgave Universidad Central de Venezuela, Bibliotheekedities. Venezuela, Caracas.
- "Giemsa vlek." Wikipedia, de gratis encyclopedie. 1 sep. 2017, 01:02 UTC. 6 december 2018, en.wikipedia.org.


