Kinyoun kleuringfundering en technieken
de Kinyoun-kleuring Het is een kleurtechniek die wordt gebruikt om zuurvaste bacteriën en zure parasieten te kleuren. Het werd geboren uit de wijziging van de kleuring van Ziehl-Neelsen; Beide technieken worden op dezelfde manier geïnterpreteerd, maar ze verschillen in twee elementen: bij de bereiding van het belangrijkste reagens en in die zin dat de Kinyoun-techniek geen warmte gebruikt.
Om deze reden is het ook bekend als koud-gemodificeerde Ziehl-Neelsen of Kinyoun koude kleuring. Het is geïndiceerd voor de kleuring van Mycobacterium tuberculosis, Mycobacterium leprae, atypische mycobacteriën, Nocardias sp, Cryptosporidium parvum, Cryptosporidium meleagridis, Cryptosporidium felis, Cryptosporidium muris en Cyclosporas cayetanensis.
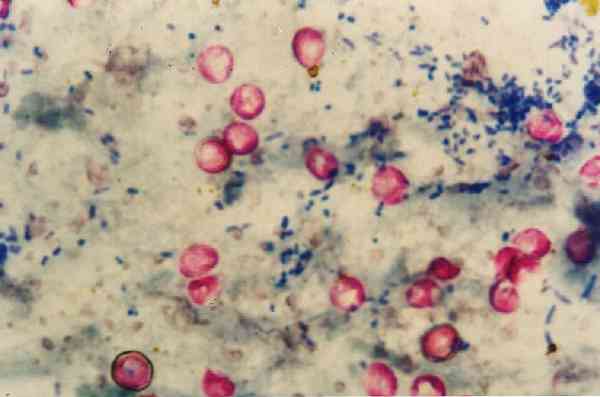
Vermeldenswaard is dat de Nocardias zwakjes kleuren met deze techniek omdat ze gedeeltelijk zuurbestendige alcohol zijn, dus voor dit genre is er een aanpassing van de methodologie.
Op zijn beurt werd de koude techniek van Kinyoun gecombineerd met de door Didier aangepaste trichrome-techniek voor de detectie van coccidia (Cryptosporidium parvum en Isospora belli) en sporen van microsporidia (Enterocytozoon bieneusi en Encephalitozoon intestinalis).
index
- 1 Foundation
- 2 Techniek
- 2.1 Materialen
- 2.2 Bereiding van Kinyoun-fuchsine met feniks
- 2.3 Bereiding van alcoholzuur
- 2.4 Bereiding van methyleenblauw contrastkleurstof
- 2.5 Kinyoun-kleuringstechniek
- 2.6 Speciale Kinyoun-techniek voor Nocardias
- 2.7 Gecombineerde techniek van fenol en trichroom fuchsine gemodificeerd door Didier
- 2.8 Kwaliteitscontrole
- 3 Kinyoun-techniek in vergelijking met de Ziehl-techniek - Neelsen
- 4 Referentie
stichting
Het belangrijkste kleuringsreagens is carbol fuchsin of fuchsin fenicada, dat de eigenschap heeft te binden aan de carbolzuren in de wasachtige celwand, rijk aan lipiden (mycolzuren) van mycobacteriën en bepaalde parasieten..
Die unie wordt niet tegengewerkt door zuurverkleuring; daarom worden micro-organismen gedefinieerd als zuurbestendige alcohol.
Anders dan de Ziehl-Neelsen-techniek - die de kleurstof door warmte fixeert - in de Kinyoun-techniek is deze stap niet nodig, omdat de fenolische fuchsine-oplossing die voor deze techniek is bereid, een hoge concentratie fenol bevat..
Fenol lost het lipidemateriaal van de celwand op, waardoor de follikel kleurstof van de bol kan worden opgenomen. Nadat de kleurstof is doorgedrongen, blijft deze vast, ondanks het wassen met alcoholzuur.
Op deze manier krijgen de zuurbestendige micro-organismen de karakteristieke rode kleur, terwijl alles dat geen zuurbestendige alcohol is verkleurd en blauw geverfd wordt..
techniek
materialen
- Gemodificeerd fenolisch fuchsine.
- alcohol -azijnzuur.
- Methyleenblauw.
Bereiding van Kinyoun-fuchsine met feniks
- Basis fuchsin: 4 gr.
- Fenol: 8 ml.
- Alcohol (95%): 20 ml.
- Gedestilleerd water: 100 ml.
Het basische fuchsine in alcohol moet langzaam worden opgelost en constant worden gemengd. Vervolgens wordt het gekristalliseerde fenol gesmolten in een waterbad bij 56 ° C. Eenmaal opgelost, voeg 8 ml toe aan de hierboven bereide fuchsine-oplossing.
Bereiding van alcoholzuur
- Geconcentreerd zoutzuur: 3 ml.
- Ethanol (95%): 97 ml.
Het moet worden gemeten, verbonden en gemengd.
Bereiding van methyleenblauw contrastkleurstof
- Methyleenblauw: 0,3 g.
- Gedestilleerd water: 100 ml.
Het wordt gewogen en opgelost.
Kinyoun-kleuringstechniek
1- Bereid direct een uitstrijkje uit het monster, dat sputum, longvloeistof, urinesediment, hersenvocht of uitwerpselen kan zijn; of uit een suspensie van micro-organismen verkregen uit zuivere kolonies ontwikkeld in primaire kweekmedia.
2- Bevestig het uitstrijkje met warmte.
3- Plaats het uitstrijkje op de inkleuringsbrug en dek af met bereid Kinyoun's fenolische fuchsine-reagens. Laat het 3 of 5 minuten zitten.
4- Was met gedestilleerd water.
5- Bleken met zuuralcohol gedurende 3 minuten en was opnieuw met gedestilleerd water.
6- Opnieuw bleken met zuuralcohol gedurende 1 of 2 minuten totdat er geen kleurstof meer wordt meegesleurd.
7- Was met gedistilleerd water en laat uitlekken, plaats de schuif in een rechtopstaande positie.
8- Bedek het preparaat met methyleenblauw en laat het 4 minuten staan.
9- Was met gedestilleerd water en laat de lucht drogen.
10- Onderzoek naar 40X en vervolgens naar 100X.
Als u de kleuring van zuurvaste micro-organismen wilt verbeteren en versnellen, voegt u 1 druppel van een bevochtigingsmiddel (zoals tergitol nr. 7) toe aan 30 of 40 ml fenol-fuchsine van Kinyoun..
Sommige laboratoria veranderen methyleenblauw contrastkleurstof voor helder groen of pikrinezuur; de eerste geeft een groene kleur aan de achtergrond en de tweede genereert een gele kleur.
Kinyoun-techniek speciaal voor Nocardias
Om de kleuring van Nocardia-bacteriën te verbeteren, wordt een modificatie van Kinyoun-kleuring gebruikt. De techniek is als volgt:
1- Bedek het uitstrijkje met Kinyoun-fencing fuchsin gedurende 3 minuten.
2- Was met gedestilleerd water.
3- Kort bleken met 3% bereide zuuralcohol tot er geen kleurstof meer wordt meegevoerd.
4- Was opnieuw met gedestilleerd water.
5- Bedek het preparaat met methyleenblauw en laat het 30 seconden staan.
6- Was met gedestilleerd water en laat de lucht drogen.
Gecombineerde techniek van fenol en trichroom fuchsine gemodificeerd door Didier
Deze techniek wordt aanbevolen voor de analyse van ontlastingsmonsters op zoek naar coccidia en sporen van Microsporidium sp op hetzelfde moment De te volgen procedure is als volgt:
1- Bedek het uitstrijkje met Kinyoun-fenolische fuchsine gedurende 10 minuten.
2- Verwijder de kleurstof en was met gedestilleerd water.
3- Bleek gedurende 30 seconden met alcohol zoutzuur.
4- Was opnieuw met gedestilleerd water.
5- Bedek het uitstrijkje met trichrome oplossing gedurende 30 minuten bij 37 ° C.
6- Was met gedestilleerd water.
7- Decoloriseer gedurende 10 seconden met alcoholazijnzuur.
8- Was het uitstrijkje gedurende 30 seconden met 95% ethanol.
Kwaliteitscontrole
Als een positieve controle worden uitstrijken voorbereid met stammen van Mycobacterium tuberculosis en gekleurd met de bereide reagentia om te verifiëren dat de bacteriën de juiste kleur aannemen (rood-fuchsia).
Negatieve controles kunnen ook worden gebruikt door uitstrijkjes te bereiden met elke stam die geen zuurbestendige alcohol is, waardoor wordt gecontroleerd of het hele monster de kleur van contrast heeft.
Kinyoun-techniek in vergelijking met de Ziehl-techniek - Neelsen
De Kinyoun-techniek is eenvoudiger omdat het de stap van het verwarmen elimineert, maar het belangrijkste voordeel is dat het de uitstoot van dampen voorkomt, zeer toxisch is en op lange termijn kanker veroorzaakt. Daarom is Kinyoun-kleuring veiliger voor het kleuren van personeel.
Het is belangrijk om er rekening mee te houden dat het noodzakelijk is om ervoor te zorgen dat de reagentia niet in direct contact komen met de huid, omdat ze bijtend zijn en het bleekmiddel ontvlambaar is.
Wat de nadelen betreft, betekent een negatieve uitstrijk niet noodzakelijk dat het micro-organisme niet aanwezig is. Bovendien kan de aanwezigheid van celafval valse positieven veroorzaken, wat bij de diagnose tot verwarring leidt.
referentie
- Toegepaste klinische chemie (2016). BK Kinyoun Kit. Beschikbaar bij: cromakit.es
- Orozco-Rico Miguel. Kinyoun-kleuring en twee coccidia bij HIV. Medical Journal MD. 2011; 3 (2): 137
- Forbes B, Sahm D, Weissfeld A (2009). Microbiologische diagnose van Bailey & Scott. 12 ed. Argentinië. Panamericana S.A Editorial.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Microbiologische diagnose. (5de ed.). Argentinië, redactie Panamericana S.A..
- Bijdragers van Wikipedia. "Kinyoun vlek." Wikipedia, de gratis encyclopedie. Wikipedia, The Free Encyclopedia, 8 Feb. 2018. Web. 5 januari 2019.
- Combol A, Fernández N, Figueredo E, Acuña A, Zanetta E. Implementatie van een kleuringstechniek voor de gelijktijdige diagnose van Coccidia en Microsporidia. Institute of Hygiene van de University of the Republic. Montevideo. Uruguay. Beschikbaar bij: higiene.edu.uy


