Ziehl-Neelsen Vlekkenstichting, reagentia en techniek
de Ziehl-Neelsen vlek in een kleurtechniek om alcoholzuurresistente micro-organismen (AAR) te identificeren. De naam van deze microbiologische procedure verwijst naar de auteurs: de bacterioloog Franz Ziehl en de patholoog Friedrich Neelsen.
Deze techniek is een soort differentiële kleuring, wat het gebruik van verschillende kleurstoffen impliceert om een contrast te creëren tussen de structuren die u wilt observeren, differentiëren en later identificeren. Ziehl-Neelsen-kleuring wordt gebruikt om bepaalde soorten micro-organismen te identificeren.
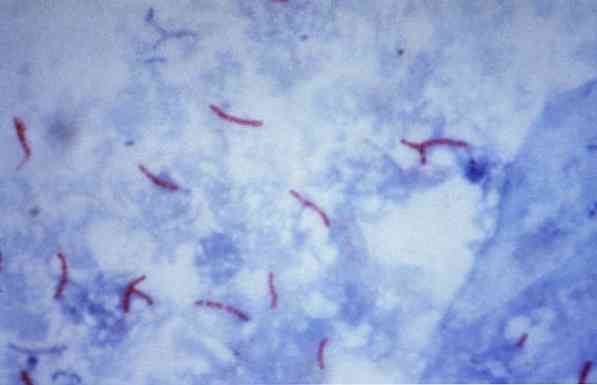
Sommige van deze micro-organismen zijn mycobacteriën (bijvoorbeeld, Mycobacterium tuberculosis), nocardias (bijvoorbeeld, Nocardia sp.) en enkele eencellige parasieten (bijvoorbeeld, Cryptosporidium parvum). Veel van de bacteriën kunnen worden geclassificeerd door middel van een veelgebruikte techniek die Gram-kleuring wordt genoemd.
Sommige bacteriële groepen vereisen echter andere methoden om ze te identificeren. Technieken zoals Ziehl-Neelsen-kleuring vereisen combinaties van kleurstoffen met warmte om de eerste aan de celwand te bevestigen.
Daarna komt een verkleuringsproces dat twee resultaten mogelijk maakt: weerstand of gevoeligheid voor verkleuring door zuren en alcoholen.
index
- 1 Foundation
- 1.1 Secundaire kleuring
- 2 reagentia
- 2.1 Primaire kleuren
- 2.2 Ontkleuren oplossing
- 2.3 Secundaire kleuring (anti-kleurstof)
- 3 Techniek
- 3.1 Zuursterke kleuringsprocedure
- 4 Referenties
stichting
De basis van deze kleuringstechniek is gebaseerd op de celwand-eigenschappen van deze micro-organismen. De wand wordt gevormd door een type vetzuren, mycolzuren genaamd; Deze worden gekenmerkt door zeer lange ketens.
Wanneer vetzuren zeer lange structuren hebben, kunnen ze kleurstoffen gemakkelijker vasthouden. Sommige geslachten van bacteriën zijn erg moeilijk te kleuren door Gram-kleuring, vanwege het hoge mycolzuurgehalte van de celwand.
In de Ziehl-Neelsen-beits wordt de fenolhoudende stof carbol fuchsin, een basische kleurstof, gebruikt. Dit heeft het vermogen om in wisselwerking te treden met de vetzuren van de celwand, wat een wasachtige textuur is bij kamertemperatuur.
Carbol fuchsin kleuring is verbeterd in de aanwezigheid van warmte, omdat de was smelt en de kleurstofmoleculen sneller in de celwand bewegen.
Het zuur dat later wordt gebruikt dient om de cellen te verkleuren die niet gekleurd waren omdat hun wand niet voldoende gerelateerd was aan de kleurstof; daarom is de sterkte van de zure ontkleurer in staat om de zure kleurstof te verwijderen. De cellen die deze verkleuring weerstaan, worden zuurbestendig genoemd.
Secundaire kleuring
Na de verkleuring van het monster staat dit in contrast met een andere kleurstof die secundaire kleurstof wordt genoemd. Methyleenblauw of malachietgroen wordt in het algemeen gebruikt.
De secundaire kleurstof kleurt het achtergrondmateriaal en vormt dientengevolge een contrast met de structuren die in de eerste stap werden geverfd. Alleen de verkleurde cellen absorberen de tweede kleurstof (anti-vlek) en nemen hun kleur aan, terwijl de zuurbestendige cellen de rode kleur behouden.
Deze procedure wordt vaak gebruikt voor de identificatie van Mycobacterium tuberculosis en Mycobacterium leprae, die zuurvaste bacillen worden genoemd.
reagentia
Primaire kleuren
Carboxin 0,3% fuchsine (gefilterd) wordt gebruikt. Deze kleurstof wordt bereid uit een mengsel van alcoholen: fenol in ethanol (90%) of methanol (95%), en in dit mengsel wordt 3 gram basisch fuchsine opgelost.
Ontkleuringsoplossing
In deze stap kunt u oplossingen van 3% alcoholzuur of 25% zwavelzuur gebruiken.
Secundaire kleuring (anti-kleurstof)
De kleurstof die het meest wordt gebruikt om het contrast in de monsters uit te voeren, is gewoonlijk 0,3% methyleenblauw. Er kunnen echter ook andere worden gebruikt, zoals 0,5% malachietgroen.
techniek
Zuurvaste kleuringsprocedure
Maak een bacterieel uitstrijkje
Deze voorbereiding is gemaakt op een schone en droge glijbaan, na voorzorgsmaatregelen voor steriliteit.
Het uitstrijkje drogen
Laat het uitstrijkje op kamertemperatuur drogen.
Verwarm het monster
Het monster moet worden verwarmd door vuur op de onderstaande dia aan te brengen. Een fixatie met alcohol kan worden gedaan als het uitstrijkje niet is bereid met sputum (behandeld met natriumhypochloriet om het witter te maken) en als het niet onmiddellijk wordt geverfd..
M. tuberculosis Het wordt geëlimineerd met bleek en tijdens het kleuringproces. Thermofixing van onbehandeld sputum zal niet doden M. tuberculosis, terwijl fixatie met alcohol bacteriedodend is.
Bedek de vlek
De vlek is bedekt met de carbol fuchsine-oplossing (primaire basisvlek).
Verhit de vlek
Dit gebeurt gedurende 5 minuten. U moet een dampafgifte opmerken (ongeveer 60 ° C). Het is belangrijk om niet oververhit te raken en het verbranden van het monster te voorkomen.
Met betrekking tot het verhitten van de vlek, moet grote zorg worden besteed aan het verwarmen van fuchsin carbol, vooral als de kleuring wordt uitgevoerd op een schaal of andere container waarin licht ontvlambare chemicaliën zijn verzameld van de vorige vlek.
Er mag alleen een kleine vlam onder de objectglaasjes worden aangebracht met behulp van een verlicht wattenstaafje dat vooraf is bevochtigd met een paar druppels zuuralcohol, methanol of 70% ethanol. Vermijd het gebruik van een grote staaf gedrenkt in ethanol, want dit is een brandgevaar.
Was de vlek
Dit wassen moet gedaan worden met schoon water. Als het leidingwater niet schoon is, was het uitstrijkje dan met gefilterd of gedistilleerd water, bij voorkeur.
Bedek het uitstrijkje met zure alcohol
Deze zure alcohol moet 3% zijn. Dekking wordt uitgevoerd gedurende 5 minuten of totdat het uitstrijkje voldoende verkleurd is, dat wil zeggen bleekroze.
Er moet rekening worden gehouden met het feit dat zure alcohol ontvlambaar is; daarom moet het heel voorzichtig worden gebruikt. Vermijd in de buurt van ontstekingsbronnen te zijn.
Was de vlek
Het wassen moet met schoon, gedestilleerd water gebeuren.
Bedek het uitstrijkje met kleurstof
Het kan groene malachiet (0,5%) of methyleenblauwe (0,3%) kleurstof zijn gedurende 1 of 2 minuten, waarbij de langste tijd wordt gebruikt als het uitstrijkje dun is.
Was de vlek
Schoon water moet opnieuw worden gebruikt (gedestilleerd).
draineren
De achterkant van de dia moet worden schoongemaakt en de vlek moet op een aflegplank worden geplaatst, zodat deze aan de lucht wordt gedroogd (gebruik geen absorberend papier om te drogen).
Bestudeer het uitstrijkje in de microscoop
Het 100X-objectief en de immersieolie moeten worden gebruikt. Scan het uitstrijkje systematisch en noteer de relevante waarnemingen.
Interpreteer de resultaten
Theoretisch worden micro-organismen die een roodachtige kleur hebben geverfd beschouwd als zuurvast positief (AAR +).
Als de micro-organismen daarentegen blauw of groen gekleurd zijn, worden ze, afhankelijk van de kleurstof die als tegenkleurstof wordt gebruikt, beschouwd als negatief alcoholresistent zuur (AAR-).
referenties
- Apurba, S. & Sandhya, B. (2016). Essentials of Practical Microbiology (1e ed.). Jaypee Brothers Medical Publishers.
- Bauman, R. (2014). Microbiologie met ziekten door Body System (4de ed.). Pearson Education, Inc.
- Heritage, J., Evans, E. & Killington, A. (1996). Inleidende Microbiologie (1e ed.). Cambridge University Press.
- Morello, J., Granato, P. Wilson, M. & Morton, V. (2006). Laboratoriumhandboek en werkboek in de microbiologie: toepassingen voor patiëntenzorg (11de ed.). McGraw-Hill Education.
- Vasanthakumari, R. (2007). Textbook of Microbiology (1e ed.). B.I. Publicaties PVT.


