Ketones Types, Properties, Nomenclature, Uses and Examples
de ketonen het zijn organische verbindingen die een carbonylgroep (-CO) bezitten. Het zijn eenvoudige verbindingen waarin de koolstof van de carbonylgroep is gebonden aan twee koolstofatomen (en hun substituentketens). Ketonen zijn "eenvoudig" omdat ze geen reactieve groepen hebben zoals -OH of -Cl gehecht aan koolstof.
Ten slotte wordt de eliminatie van ketonen uit het menselijk lichaam gewoonlijk geassocieerd met een laag suikergehalte (bij diabetische gevallen en / of extreem vasten), wat ernstige gezondheidsproblemen voor de patiënt kan veroorzaken.
index
- 1 Algemene formule van ketonen
- 2 soorten ketonen
- 2.1 Volgens de structuur van uw ketting
- 2.2 Volgens de symmetrie van zijn radicalen
- 2.3 Volgens de verzadiging van zijn radicalen
- 2.4 Dicetones
- 3 Fysische en chemische eigenschappen van ketonen
- 3.1 Kookpunt
- 3.2 Oplosbaarheid
- 3.3 Zuurgraad
- 3.4 Reactiviteit
- 4 nomenclatuur
- 5 Verschil tussen aldehyden en ketonen
- 6 Toepassingen in de industrie en het dagelijks leven
- 7 Voorbeelden van ketonen
- 7.1 Butanon (C4H8O)
- 7.2 Cyclohexanon (C6H10O)
- 7.3 Testosteron (C19H22O2)
- 7.4 Progesteron (C21H30O2)
- 8 Referenties
Algemene formule van ketonen
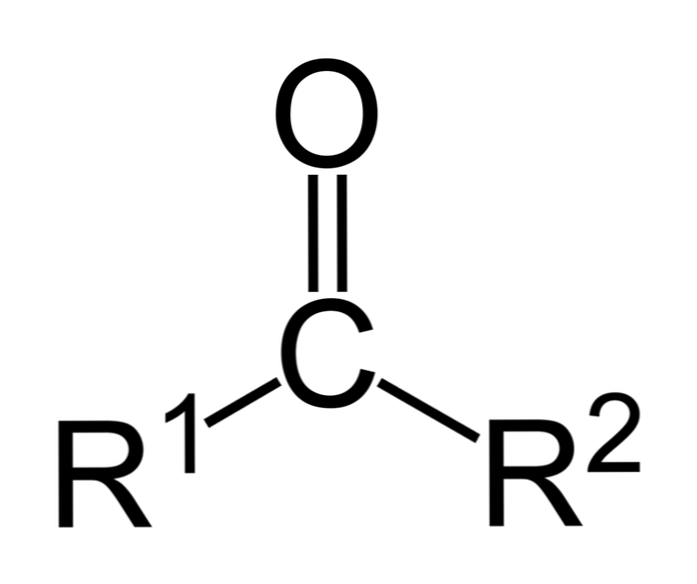
Ketonen zijn carbonylverbindingen waarin deze groep is gebonden aan twee koolwaterstofgroepen; dit kunnen alkylgroepen, benzeenringgroepen of beide zijn.
Een keton kan eenvoudig worden weergegeven als R- (C = O) -R 'waarbij R en R' hetzij twee koolwaterstofketens (alkanen, alkenen, alkynen, cycloalkanen, benzeenderivaten en anderen). Er zijn geen ketonen met een waterstof gekoppeld aan de carbonylgroep.
Er is een grote verscheidenheid aan methoden voor de bereiding van ketonen in de industriële en laboratoriumomgeving; Bovendien is het belangrijk op te merken dat ketonen kunnen worden gesynthetiseerd door verschillende organismen, waaronder mensen.
In de industrie omvat de meest gebruikelijke methode voor de synthese van ketonen de oxidatie van koolwaterstoffen, typisch met het gebruik van lucht. Op kleine schaal worden ketonen gewoonlijk bereid door de oxidatie van secundaire alcoholen, die als producten een keton en water geven.
Naast deze meest gebruikelijke methoden, kunnen ketonen worden gesynthetiseerd via alkenen, alkynen, zouten van stikstofverbindingen, esters en vele andere verbindingen, waardoor ze gemakkelijk te verkrijgen zijn.
Soorten ketonen
Er zijn verschillende classificaties voor ketonen, voornamelijk afhankelijk van de substituenten in hun keten R. De volgende zijn de meest voorkomende classificaties voor deze stoffen:
Volgens de structuur van je ketting
In dit geval wordt het keton ingedeeld door de wijze waarop zij wordt opgebouwd keten alifatische ketonen zijn die met twee R en R 'radicalen met alkylradicalen vormen (alkanen, alkenen, alkynen en cycloalkanen).
Van hun kant zijn aromaten die die benzeenderivaten vormen, terwijl ze nog steeds ketonen zijn. Tenslotte zijn gemengde ketonen die welke een R-alkylrest en een R'-arylrest hebben, of omgekeerd.
Volgens de symmetrie van zijn radicalen
In dit geval worden de resten R en R 'substituenten van de carbonylgroep bestudeerd; wanneer deze gelijk zijn (identiek) wordt het keton symmetrisch genoemd; maar wanneer ze verschillend zijn (zoals de meeste ketonen), wordt dit asymmetrisch genoemd.
Volgens de verzadiging van zijn radicalen
Ketonen kunnen ook worden geclassificeerd op basis van de verzadiging van hun koolstofketens; Als deze de vorm van alkanen hebben, wordt het keton een verzadigd keton genoemd. Daarentegen, als de ketens worden gevonden als alkenen of alkynen, wordt het keton onverzadigd keton genoemd.
diketonen
Dit is een afzonderlijke klasse van ketonen, omdat de ketens van dit keton twee carbonylgroepen in hun structuur hebben. Sommige van deze ketonen hebben unieke kenmerken, zoals een langere lengte van de binding tussen koolstofatomen.
Diketonen afgeleid van cyclohexaan zijn bijvoorbeeld bekend als chinonen, die slechts twee zijn: ortho-benzoquinon en para-benzoquinon.
Fysische en chemische eigenschappen van ketonen
Ketonen, zoals de meeste aldehyden, zijn vloeibare moleculen en hebben een reeks fysische en chemische eigenschappen die variëren afhankelijk van de lengte van hun kettingen. De eigenschappen worden hieronder beschreven:
Kookpunt
Ketonen zeer vluchtige, polaire en nagenoeg geen waterstof kan doneren aan waterstofbindingen (waterstofatomen gebonden aan de carbonylgroep bezitten), zodat aanwezige punten hogere alkenen en ethers koken, maar lager dan alcoholen met hetzelfde molecuulgewicht.
Het kookpunt van een keton neemt toe naarmate de grootte van het molecuul toeneemt. Dit komt door de tussenkomst van de Van der Waals-krachten en de dipool-dipoolkrachten, die een grotere hoeveelheid energie vereisen om de atomen en elektronen die door het molecuul worden aangetrokken te scheiden..
oplosbaarheid
De oplosbaarheid van ketonen heeft een sterke invloed ten dele op het vermogen van deze moleculen om waterstofatomen in hun zuurstofatoom te accepteren en zo een waterstofbinding met water te vormen. Bovendien worden aantrekkelijke, verstrooiende en dipool-dipoolkrachten gevormd tussen ketonen en water, die hun oplosbaar effect vergroten.
Ketonen verliezen de oplosbaarheid, hoe groter hun molecuul, omdat ze meer energie nodig hebben om in water op te lossen. Ze zijn ook oplosbaar in organische verbindingen.
zuurheid
Dankzij de carbonylgroep hebben ketonen een zuur karakter; dit gebeurt vanwege de resonantie-stabilisatiecapaciteit van deze functionele groep, die protonen kan overbrengen van zijn dubbele binding om een geconjugeerde base genaamd enol te vormen.
reactiviteit
Ketonen maken deel uit van een groot aantal organische reacties; dit gebeurt als gevolg van de gevoeligheid van de carbonylkoolstof voor de nucleofiele toevoeging, naast de polariteit hiervan.
Zoals hierboven vermeld, maakt de hoge reactiviteit van ketonen hen tot een erkend tussenproduct dat als basis dient voor de synthese van andere verbindingen.
nomenclatuur
Ketonen genoemd naar de prioriteit of belang van de carbonylgroep in het gehele molecuul, dus als een molecuul wordt geregeld door de carbonylgroep, wordt het keton genoemd door toevoeging van het achtervoegsel "-on" de naam van de koolwaterstof.
De langste keten met de carbonylgroep wordt als de hoofdketen genomen en vervolgens wordt het molecuul genoemd. Als de carbonylgroep geen prioriteit heeft boven de andere functionele groepen van het molecuul, dan wordt het geïdentificeerd met "-oxo".
Voor meer gecompliceerde ketonen kan de positie van de functionele groep met een aantal bij diketonen (ketonen met twee substituenten R en 'identieke R) identificeren, en wordt het molecuul naam met het achtervoegsel 'dion'.
Tenslotte kan het woord "keton" ook worden gebruikt na het identificeren van de ketens van radicalen die aan de carbonyl-functionele groep zijn bevestigd.
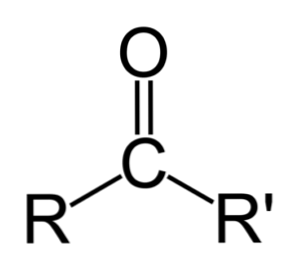
Het verschil tussen aldehyden en ketonen
Het grootste verschil tussen aldehyden en ketonen is de aanwezigheid van een waterstofatoom verbonden aan de carbonylgroep in de aldehyden.
Dit atoom een belangrijk effect bij een molecuul betrokken bij een oxidatiereactie: een aldehyde een carbonzuur of carbonzuurzout, naargelang de oxidatie plaatsvindt onder zure of basische omstandigheden.
Daarentegen heeft een keton deze waterstof niet, dus de minimale stappen die nodig zijn voor oxidatie treden niet op.
Er zijn methoden om een keton te oxideren (met oxidatiemiddelen die veel krachtiger zijn dan die typisch worden gebruikt), maar deze breken het ketonmolecuul en scheiden het eerst in twee of meer delen.
Industrieel en dagelijks gebruik
In de industrie worden ketonen vaak waargenomen in parfums en verven, waarbij ze de rol aannemen van stabilisatoren en conserveermiddelen die voorkomen dat andere bestanddelen van het mengsel worden afgebroken; ze hebben ook een breed spectrum als oplosmiddelen in die industrieën die explosieven, verven en textiel produceren, naast farmaceutische producten.
Aceton (de kleinste en eenvoudigste keton) is een wereldwijd erkend oplosmiddel en wordt gebruikt als verfverwijderaar en verdunner.
In de natuur kunnen ketonen verschijnen als suikers, ketosen genoemd. Ketoses zijn monosacchariden die één keton per molecuul bevatten. De bekendste ketose is fructose, de suiker die wordt aangetroffen in fruit en honing.
De vetzuurbiosynthese die optreedt in het cytoplasma van dierlijke cellen vindt ook plaats door de werking van ketonen. Tenslotte, en zoals hierboven vermeld, kan er een verhoging van ketonen in het bloed zijn na vasten of in diabetische gevallen.
Voorbeelden van ketonen
Butanon (C4H8O)
Deze vloeistof, ook bekend als MEK (of MEC), wordt op grote schaal in de industrie geproduceerd en wordt als oplosmiddel gebruikt.
Cyclohexanon (C6H10O)
Geproduceerd op grote schaal, wordt dit keton gebruikt als een voorloper van het synthetische nylon materiaal.
Testosteron (C19H22O2)
Het is het belangrijkste hormoon van het mannelijk geslacht en een anabole steroïde, aangetroffen bij de meeste gewervelde dieren.
Progesteron (C21H30O2)
Endogeen steroïde en geslachtshormoon betrokken bij de menstruatiecyclus, zwangerschap en embryogenese bij mensen en andere soorten.
referenties
- Wikipedia. (N.D.). Keton. Opgehaald van en.wikipedia.org
- Britannica, E. (s.f.). Keton. Opgehaald van britannica.com
- Universiteit, M. S. (s.f.). Aldehyden en ketonen. Teruggeplaatst van chemistry.msu.edu
- ChemGuide. (N.D.). Introductie van aldehyden en ketonen. Opgehaald van chemguide.co.uk
- Calgary, U. O. (s.f.). Ketonen. Opgehaald van chem.ucalgary.ca


