Calciumhydroxideformule, eigenschappen, reactiviteit en toepassingen
de calciumhydroxide, ook bekend als gehydrateerde kalk of gebluste kalk, is een anorganische verbinding met formule Ca (OH)2.
Het calciumhydroxide neemt een polymere structuur aan, zoals alle metaalhydroxiden, die identiek zijn aan die van magnesiumhydroxide (Mg (OH))2) ook bekend als brucita.
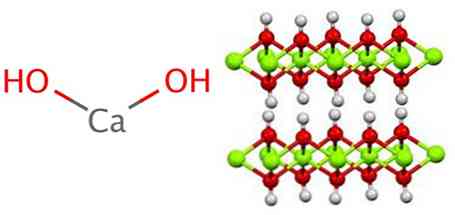
Het is duidelijk dat in deze structuur waterstofbruggen worden gevormd. Calciumhydroxide wordt industrieel gesynthetiseerd door calciumoxide, ook bekend als kalk of ongebluste kalk, te laten reageren met water volgens de volgende reactie:
CaOH + H2O → Ca (OH)2
Het wordt ook in het laboratorium bereid door de reactie tussen waterig calciumchloride en natriumhydroxide.
Calciumhydroxide komt van nature voor, maar komt zelden voor in zijn minerale vorm als portlandiet, dat voorkomt in sommige vulkanische en metamorfe gesteenten. (Calcium hydroxide Formula - Calcium hydroxide Uses, Properties, Structure and Formula, 2005-2017).
Deze verbinding is ook algemeen verkrijgbaar in cement, oplosmiddel en industriële reinigingsmiddelen (zoals bouwproducten), vloerstrippers, baksteenreinigers, cementverdikkingsproducten en vele andere..
De waterige oplossing wordt gewoonlijk kalkwater genoemd. Het kalkwater wordt bereid door calciumhydroxide in zuiver water te roeren en de overmaat Ca (OH) te filtreren2 niet opgelost.
Wanneer overmaat calciumhydroxide wordt toegevoegd aan het kalkwater, wordt een suspensie van calciumhydroxidedeeltjes verkregen, waardoor het een melkachtig uiterlijk krijgt, in welk geval het de gebruikelijke naam van limoenmelk heeft. De kalkmelk of een verzadigde oplossing van kalk (kalkwater) heeft een pH van 12.3, die van een basiskarakter is.
Fysische en chemische eigenschappen van calciumhydroxide
Calciumhydroxide is een wit of kleurloos poeder, zonder geur. In waterige oplossing (verzadigde oplossingen) heeft het een melkachtig uiterlijk vanwege het supernatant van onopgelost calciumhydroxide.
Onverzadigde oplossingen zijn meestal heldere en kleurloze oplossingen, met een lichte aardachtige geur en een bittere alkalische smaak van calciumhydroxide. Het uiterlijk van de verbinding wordt geïllustreerd in Figuur 3 (Royal Society of Chemistry, 2015).

Het calciumhydroxide heeft een molecuulgewicht van 74,093 g / mol en een dichtheid van 2,211 g / cm3 in de vaste toestand. Het heeft een smeltpunt van 580 graden Celsius. Het is slecht oplosbaar in water, in staat om 1,89 gram per liter op te lossen bij 0 ° C, 1,73 gram per liter bij 20 ° C en 0,66 gram per liter bij 100 ° C.
Het is oplosbaar in glycerol en in zure oplossingen. Het is onoplosbaar in alcohol (National Center for Biotechnology Information, S.F.).
Het calciumhydroxide wordt gedeeltelijk opgelost in water om een oplossing te produceren die kalkwater wordt genoemd, wat een gematigde basis is. Kalkwater of Ca (OH)2 (aq) Het reageert met zuren om zouten te vormen en kan sommige metalen zoals aluminium aantasten. Kalkwater reageert gemakkelijk met koolstofdioxide om calciumcarbonaat te vormen, een nuttig proces dat carbonatatie wordt genoemd:
Ca (OH)2 + CO2 → CaCO3 + H2O
Nitroparaffinen, nitromethaan, nitropropaan, enz., Vormen zouten met anorganische basen zoals calciumhydroxide. Deze droge zouten zijn explosief. De verbinding is chemisch vergelijkbaar met natriumhydroxide (NaOH) of natriumoxide (Na2O). Deze neutraliseren de zuren exotherm om zouten plus water te vormen.
Het mengen van deze materialen met water kan onveilige hoeveelheden warmte genereren, naarmate de basis oplost of verdunt. Basen reageren met bepaalde metalen (zoals aluminium en zink) om metaaloxiden of hydroxiden te vormen en waterstofgas te genereren.
De basen kunnen polymerisatiereacties in polymeriseerbare organische verbindingen initiëren, in het bijzonder epoxiden. Brandbare en / of giftige gassen kunnen worden gegenereerd met ammoniumzouten, nitriden, gehalogeneerde organische stoffen, verschillende metalen, peroxiden en hydroperoxiden. Dit type verbinding dient vaak als een katalysator (Chemisch gegevensblad CALCIUM HYDROXIDE, S.F.).
Reactiviteit en gevaren

Calciumhydroxide is een stabiele verbinding, hoewel onverenigbaar met sterke zuren. Het is geclassificeerd als een irriterende stof en onder de gevaren die we kunnen benadrukken:
Het is bijtend voor de ogen (ze veroorzaken corneale schade of blindheid) en de huid (ze produceren ontstekingen en blaren).
Inademing van stof veroorzaakt irritatie in het maagdarmkanaal of de luchtwegen, gekenmerkt door verbranding, niezen en hoesten. Ernstige overbelichting kan longbeschadiging, verstikking, bewusteloosheid of de dood veroorzaken. Ontsteking van het oog wordt gekenmerkt door roodheid, irritatie en jeuk (Material Safety Data Sheet Calcium hydroxide, 2013).
Herhaalde blootstelling aan de ogen bij een laag stofniveau kan irritatie en lokale huidbeschadiging of dermatitis op de huid veroorzaken. Herhaaldelijke inademing van stof kan een variabele mate van irritatie van de luchtwegen of longschade veroorzaken.
Als deze chemische stof in contact komt met de ogen, moeten deze onmiddellijk worden gewassen met grote hoeveelheden water, waarbij af en toe de onder- en bovenoogleden worden opgetild. Onmiddellijke medische aandacht moet worden verkregen. Contactlenzen mogen niet worden gebruikt bij het werken met deze chemische stof.
Als deze chemische stof in contact komt met de huid, moet de huid die is verontreinigd met water en zeep onmiddellijk worden afgespoeld. Als deze chemische stof in kleding binnendringt, verwijder dan onmiddellijk kleding en spoel de huid met water. Als irritatie aanhoudt na het wassen, medische hulp inroepen.
Als grote hoeveelheden van deze stof worden ingeademd, moet de blootgestelde persoon onmiddellijk in de frisse lucht worden gebracht. Als de ademhaling is gestopt, voer dan mond-op-mond-reanimatie uit, waarbij het slachtoffer ook warm en in rust gehouden wordt. Roep zo snel mogelijk medische hulp in.
In geval van inslikken onmiddellijk een arts raadplegen en indien mogelijk verpakking of etiket tonen (Calciumhydroxidevergiftiging, 2017).
Behandeling en opslag
- De verbinding moet in een droge container worden bewaard.
- Het stof niet inslikken of inademen.
- Water mag nooit aan dit product worden toegevoegd.
- In geval van onvoldoende ventilatie, zorg voor voldoende ademhalingsapparatuur.
- Vermijd contact met huid en ogen.
- Verwijderd houden van onverenigbaar als zuren.
- Houd de container goed gesloten.
- Bewaar de container op een koele en goed geventileerde plaats. Bewaar niet boven 25 graden Celsius.
Toepassingen en toepassingen

Calciumhydroxide wordt op grote schaal geproduceerd, het is gemakkelijk te hanteren en het is over het algemeen goedkoop, daarom zijn er veel opvallende toepassingen en toepassingen.
Een significante toepassing van calciumhydroxide is als een flocculant in water en afvalwaterzuivering. Het vormt een donzige, geladen vaste stof die helpt bij het verwijderen van kleinere deeltjes uit het water, wat resulteert in een lichter product.
Deze toepassing wordt mogelijk gemaakt door de lage kosten en lage toxiciteit van calciumhydroxide. Het wordt ook gebruikt voor de behandeling van zoet water om de pH van het water te verhogen. Het doel is dat de buizen niet corroderen waar het basiswater zuur is.
Een andere geweldige toepassing is in de papierindustrie, waar het wordt gebruikt bij de productie van natriumhydroxide. Deze omzetting is een component van het bekende kraftproces dat wordt gebruikt bij de extractie van pulp.
In levensondersteunende systemen zoals kooldioxide-wasser, met name in gesloten beademings-beademingsapparaten, waarbij lithiumhydroxide, dat meer bijtend is, als te riskant wordt beschouwd.
Het wordt gebruikt als een ingrediënt in bleken en pleisteren, met de zogenaamde kalkmortels. Bij de aanleg van wegen dient calciumhydroxide om de kwaliteit van de bodem te verbeteren.
Volgens de National Institutes of Health wordt calciumhydroxide vaak gebruikt in de tandheelkunde als een antimicrobieel middel en is het de aangewezen stof om een beschermende laag te vormen die bekend staat als een apicale barrière..
Apicale barrières worden vaak gebruikt als een middel om pulpale necrose te voorkomen in situaties waar endodontische chirurgie bijzonder moeilijk zou zijn, wat meestal het gevolg is van een onvolgroeide permanente tand.
Omdat calciumhydroxide kan helpen bij het desinfecteren van een tand waar een infectie al bestaat, kan het worden gebruikt als een kortdurende behandeling om pijn en ontsteking te verminderen ter voorbereiding op endodontische chirurgie (Gottfried Schmalz, 2009).
Het dient als een additief voor zeewater omdat het atmosferische CO2 vermindert en het broeikaseffect vermindert.
Bij de productie van metalen wordt kalk geïnjecteerd in de afvalgasstroom om zuren, zoals fluoriden en chloriden, te neutraliseren voordat ze in de atmosfeer vrijkomen..
Calciumhydroxide wordt gebruikt als het actieve alkalische ingrediënt in sommige haarontspanningsproducten.
Volgens het Cornell Center for Materials Research kan calciumhydroxide krullend haar rechttrekken omdat het de disulfidebindingen verbreekt die cysteïnes verbinden, de aminozuren die aanwezig zijn in hogere concentraties in natuurlijk krullend haar. Het verbreken van deze bindingen en het verzegelen ervan met calciumhydroxide verandert permanent de fysieke structuur van het behandelde haar.
In het mengsel van Bordeaux dient calciumhydroxide om de oplossing te neutraliseren en een langdurig fungicide te vormen.
Het wordt gebruikt in de olieraffinage-industrie voor de productie van olie-additieven (salicylaten, sulfaten, fenolen), in de petrochemische industrie voor de vervaardiging van vaste olie van verschillende merken en ook in de chemische industrie voor de productie van calciumstearaat. . Het wordt vaak gebruikt voor het onderzoek van koolstofdioxide en gasabsorptie.
Calciumhydroxide wordt gebruikt bij de vervaardiging van remblokken, bij de bereiding van droge mengsels voor verven en decoreren en ook bij de vervaardiging van mengsels voor bestrijdingsmiddelen.
Het wordt ook gebruikt als calciumsupplement en pH / carbonaatbuffer voor koraalaquacultuur in rifaquaria.
Het is een "alternatief" natuurlijk insecticide, de meeste kruipende insecten sterven door contact ermee, waaronder teken, vlooien, kevers en larven (Russiver, 2015).
Calciumhydroxide is een effectieve oplossing voor het scheiden van het haar van het leer van dieren, in de voorbereiding voor de productie van leer.
Een mengsel van calciumhydroxide en warm water vormt een bad waarin vers leer tot vier dagen moet worden doorweekt en vaak moet worden geschud. Dit proces maakt haar en huid zo ver los dat het meestal met de hand kan worden verwijderd.
Vanwege de lage toxiciteit en de zachtheid van de basiseigenschappen, wordt gebluste kalk veel gebruikt in de voedingsmiddelenindustrie om:
- Ter verduidelijking van het onbewerkte sap van suikerriet of suikerbiet in de suikerindustrie, proceswater voor alcoholische dranken en frisdranken, augurken en ander voedsel.
- Maak maïstortilla's (help de maïsmeel bij elkaar te komen). De mais die met limoen is gekookt, wordt omgezet in nixtamal, wat de biologische beschikbaarheid van niacine aanzienlijk verhoogt, het wordt ook smakelijker en gemakkelijker verteerbaar geacht.
- Reinig een pekel van calcium- en magnesiumcarbonaten bij de bereiding van zout voor gebruik in voeding en farmaceutica.
- Versterk fruitdranken, zoals sinaasappelsap en zuigelingenvoeding (BAUM, 2013).
referenties
- BAUM, J. (2013, 16 augustus). Calciumhydroxidetoepassingen. Opgehaald van livestrong.com: livestrong.com.
- Calciumhydroxide Formule - Calciumhydroxide Gebruik, eigenschappen, structuur en formule. (2005-2017). Opgehaald van softschools.com.
- Calciumhydroxide vergiftiging. (2017, 7 februari). Opgehaald van medlineplus.gov.
- Chemisch gegevensblad CALCIUMHYDROXIDE. (S.F.). Teruggeplaatst van cameochemicals.noaa.gov.
- Gottfried Schmalz, D.A. (2009). Biocompatibiliteit van tandheelkundige materialen. Berlijn: springer.
- Veiligheidsinformatieblad Calciumhydroxide. (2013, 21 mei). Teruggeplaatst van sciencelab: sciencelab.com.
- Nationaal centrum voor informatie over biotechnologie. (S.F.). PubChem Compound-database; CID = 6093208. Teruggeplaatst van pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). Calciumhydroxide. Opgehaald van ChemSpider: chemspider.com.
- Russiver, M. (2015, 17 augustus). Waar wordt calciumhydroxide voor gebruikt? Teruggeplaatst van quora: quora.com.


